
Particules subatomiques et leurs caractéristiques

le particules subatomiques Ils sont plus petits que l'atome et se trouvent dans la nature, presque tous en faisant partie. Nous connaissons bien les principaux et les plus stables, que sont l'électron, le proton et le neutron..
Toute matière est composée de ces particules, bien qu'il y en ait d'autres, bien que leur existence ait été longtemps ignorée. Les premiers modèles atomiques, datant de quelques siècles avant Jésus-Christ, supposaient que les atomes étaient indivisibles, quelque chose comme des billes qui, combinées d'une certaine manière, donnaient naissance aux différents éléments..
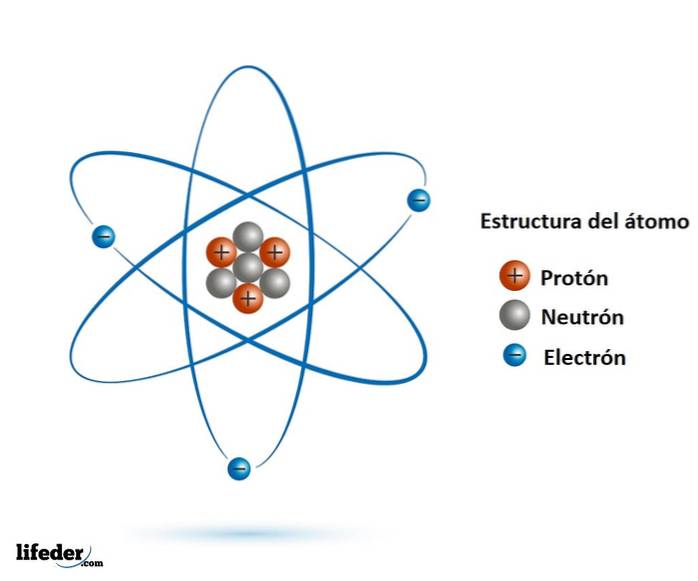
Lorsqu'on a appris que ce n'était pas le cas, grâce aux découvertes de l'électron au 19e siècle et du noyau atomique au début du 20e siècle, les scientifiques se sont demandé si ces particules avaient une structure interne..
Il s'est avéré que oui, le proton et le neutron sont des particules constituées de particules encore plus petites, qui n'ont pas de structure interne: ce sont des particules élémentaires.
C'est pourquoi les particules subatomiques sont divisées en:
- Particules composées.
- Particules élémentaires.
Les particules élémentaires sont les quarks, les gluons et les leptons. Les quarks et les gluons constituent les protons et les neutrons, tandis que l'électron, une particule élémentaire, est un lepton.
Index des articles
- 1 Découverte de particules subatomiques
- 1.1 Le noyau atomique: protons et neutrons
- 2 Les principales particules subatomiques
- 2.1 Electron
- 2.2 Proton
- 2.3 Neutron
- 2.4 Quarks
- 3 Autres particules
- 4 Références
Découverte de particules subatomiques
Les découvertes de particules subatomiques ont commencé au 19ème siècle et le premier à être trouvé était l'électron.
En 1890, les physiciens étaient très occupés à étudier les rayonnements et la transmission des ondes électromagnétiques. J. J. Thomson était l'un d'entre eux et il a effectué de nombreuses expériences avec un tube qui avait eu l'air enlevé et une paire d'électrodes attachées..

Lorsqu'une tension était appliquée, des rayons mystérieux étaient produits, appelés rayons cathodiques, dont la nature était inconnue, jusqu'à ce que J. J. Thomson (1856-1940) découvre qu'il s'agissait d'un flux de particules chargées négativement..
Thomson a obtenu le quotient entre la charge et la masse de ces particules: 1,76 x 108 C / g, où C signifie coulomb, l'unité de charge électrique dans le Système international d'unités et g est le gramme.
Et il a trouvé deux choses très importantes, la première que la masse des particules était extrêmement petite, et deuxièmement, que cette valeur était la même pour toutes, peu importe la composition des électrodes..
La valeur de la charge a été trouvée peu de temps après, au début des années 1900, par le physicien américain Robert Millikan (1868-1953) et ses collaborateurs, grâce à l'expérience de la goutte d'huile.
Le noyau atomique: protons et neutrons
À la fin du XIXe siècle, Henri Becquerel (1852-1908) avait découvert le phénomène de la radioactivité naturelle, qui intriguait d'autres physiciens comme Marie et Pierre Curie, ainsi que le Néo-Zélandais Ernest Rutherford..
Ce dernier a trouvé trois types de rayonnement différents à partir d'échantillons d'uranium, un élément radioactif connu. Il les a nommés avec les trois premières lettres de l'alphabet grec: α, β et γ.
Expériences de diffusion de Rutherford

En utilisant les particules α hautement énergétiques et chargées positivement, Rutherford a bombardé de fines feuilles d'or et a constaté que, comme prévu, la plupart des particules α passaient à travers les feuilles sans problème..
Mais curieusement, une petite fraction de particules a été déviée et quelques-unes ont même rebondi dans la direction opposée. Ce dernier était inimaginable, car comme le prétendait Rutherford, c'était comme tirer un fusil sur un mouchoir fin et regarder les balles revenir..
La raison pour laquelle les particules α sont déviées est qu'il y a quelque chose à l'intérieur de la feuille qui les repousse et qu'elle doit donc être chargée positivement. C'est le noyau atomique, de petite taille, mais contenant presque toute la masse de l'atome.
La découverte du neutron

Le neutron a mis un peu plus de temps à être trouvé et était dû au physicien anglais James Chadwick (1891-1974), étudiant à Rutherford. Rutherford lui-même avait proposé l'existence d'une particule non chargée dans le noyau, pour expliquer pourquoi elle ne se désintègre pas en raison de la répulsion électrostatique..
Les expériences de Chadwick ont révélé en 1932 l'existence d'une particule de masse très similaire à celle du proton, mais sans charge. C'est pourquoi ils l'ont appelé un neutron et avec le proton, ils sont les composants essentiels du noyau atomique.
Les principales particules subatomiques
En général, les particules subatomiques sont caractérisées en ce qu'elles ont:
- Masse.
- Charge électrique.
- Tourner.
Le spin est une qualité analogue à la rotation autour de l'axe, mais entièrement de nature quantique. Et d'autre part, il y a des particules de charge et de masse 0, comme le photon.
Électron
L'électron est une particule subatomique stable, chargée négativement et appartenant au groupe des leptons, étant celle avec la masse la plus faible. C'est une partie essentielle de l'atome, mais il peut exister isolé de lui, sous la forme de électrons libres.
En fait, c'est la plus petite charge électrique que l'on puisse trouver dans la nature, donc toute autre charge est un multiple de celle de l'électron, selon le principe de la quantification de charge..
Ses principales caractéristiques sont:
- Masse: 9,1 x 10-31 kg
- Charge: e = -1,6 x 10-19 C
- Essorage: ± ½
- Antiparticule: positron.
L'électron est responsable de la formation de liaisons chimiques, ainsi que de la conduction électrique et thermique. Et grâce à la mécanique quantique, on sait que l'électron a un double comportement: onde et particule à la fois.
Proton
C'est une particule chargée électriquement, dont la charge est la même en magnitude que celle de l'électron, mais avec le signe opposé..
Le proton n'est pas une particule élémentaire comme l'électron, mais est composé de trois quarks reliés par gluons et c'est beaucoup plus massif que l'électron.
Contrairement à cela, le proton est confiné au noyau atomique et sa quantité détermine de quel élément il s'agit, ainsi que ses propriétés..
- Masse: 1672 x 10-27 kg
- Charge: e = +1,6 x 10-19 C
- Essorage: ½
- Antiparticule: antiproton.
Neutron
Le neutron et le proton constituent le noyau atomique et il est également composé de trois quarks: deux du type vers le bas et unique en son genre en haut.
- Masse: 1675 x 10-27 kg
- Pas de frais nets.
- Essorage: ½.
C'est une particule stable dans le noyau atomique, mais en tant que particule libre, elle se désintègre avec une demi-vie d'environ 10,3 minutes. Sa masse est légèrement supérieure à celle du proton et comme nous l'avons dit, il n'a pas de charge nette..
Le nombre de neutrons dans un atome est important, car bien qu'il ne détermine pas la nature de l'élément, comme le fait le proton, il détermine la classe d'isotope..
Les isotopes d'un élément en sont des variantes et leur comportement peut être assez différent les uns des autres. Il y en a des stables et instables, par exemple l'hydrogène a du deutérium et du tritium comme isotopes.
En bombardant les atomes de certains composés d'uranium et de plutonium avec des neutrons, le noyau se fissionne et se décompose en particules. La réaction nucléaire en chaîne qui se produit est capable d'émettre une grande quantité d'énergie.
Les quarks
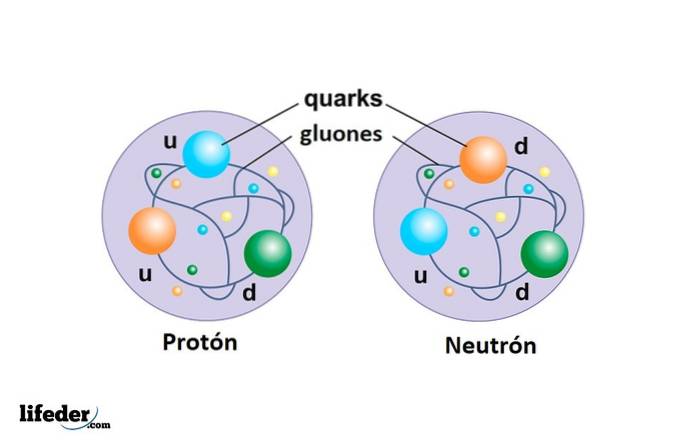
Ce sont les constituants des protons et des neutrons. Jusqu'à présent, 6 types de quarks ont été trouvés, mais aucun en tant que particule libre, mais plutôt associés pour former d'autres particules composites.
La preuve de son existence a été obtenue grâce à des expériences menées depuis les années 1960, avec l'accélérateur linéaire de Stanford et plus tard au CERN.
- Charge: + 2 / 3e, -1 / 3e
- Essorage: ½
- Antiparticule: antiquark.
Autres particules
À partir de 1930, les découvertes de nouvelles particules suivirent, dont beaucoup étaient prédites par la théorie. Le modèle standard des particules considère l'existence de 17 types de particules fondamentales, parmi les quarks, leptons, bosons et le boson de Higgs..
Ils ont également leurs antiparticules respectives qui, lorsqu'elles interagissent, s'annihilent, générant de nouvelles particules. En voici quelques uns:
-Positron, identique à l'électron mais chargé positivement.
-Neutrino, sans frais.
-méson.
-Les bosons, qui sont les porteurs d'interactions fondamentales, à l'exception de la gravité.
-Le boson de Higgs, responsable de la masse.
-Graviton, est une particule proposée pour expliquer la gravité, mais il n'y a toujours aucune preuve qu'elle existe.
Les références
- Chang, R. 2013. Chimie. 11ème. Édition. Éducation Mc Graw Hill.
- Cobian, J. Le modèle standard de particules. Récupéré de: sne.es.
- Fernández de Sala, P. Particules élémentaires, particules composites et particules virtuelles. Récupéré de: ific.uv.es.
- Giambattista, A. 2010. Physique. 2ème. Ed. McGraw Hill.
- Olmo, M. Protons et neutrons. Récupéré de: hyperphysics.phy-astr.gsu.edu.


Personne n'a encore commenté ce post.