
Unités de mesure et d'expérimentation de la loi d'Avogadro
La Loi d'Avogadro postule qu'un volume égal de tous les gaz, à la même température et à la même pression, a le même nombre de molécules. Amadeo Avogadro, un physicien italien, a proposé deux hypothèses en 1811: la première dit que les atomes des gaz élémentaires sont ensemble dans des molécules au lieu d'exister en tant qu'atomes séparés, comme l'a dit John Dalton..
La deuxième hypothèse dit que des volumes égaux de gaz à pression et température constantes ont le même nombre de molécules. L'hypothèse d'Avogadro relative au nombre de molécules dans les gaz n'a été acceptée qu'en 1858, lorsque le chimiste italien Stanislao Cannizaro a construit un système logique de chimie basé sur ce principe..

On peut déduire de la loi d'Avogadro: pour une masse donnée d'un gaz parfait, son volume et le nombre de molécules sont directement proportionnels si la température et la pression sont constantes. Cela implique également que le volume molaire des gaz qui se comportent idéalement est le même pour tous.
Par exemple, étant donné un certain nombre de ballons, étiquetés de A à Z, ils sont tous remplis jusqu'à ce qu'ils soient gonflés à un volume de 5 litres. Chaque lettre correspond à une espèce gazeuse différente; c'est-à-dire que ses molécules ont leurs propres caractéristiques. La loi d'Avogadro stipule que tous les ballons contiennent le même nombre de molécules.
Si les ballons sont maintenant gonflés à 10 litres, selon les hypothèses d'Avogadro, deux fois le nombre de taupes gazeuses initiales auront été introduits.
Index des articles
- 1 De quoi il s'agit et unités de mesure
- 1.1 Déduction de la valeur de R lorsqu'elle est exprimée en L atm / K mol
- 2 Forme usuelle de la loi d'Avogadro
- 3 Conséquences et implications
- 4 origines
- 4.1 Hypothèse d'Avogadro
- 4.2 Numéro d'Avogadro
- 5 L'expérience d'Avogadro
- 5.1 Expérience avec des conteneurs commerciaux
- 6 exemples
- 6.1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Références
De quoi il s'agit et unités de mesure
La loi d'Avogadro stipule que, pour une masse de gaz parfait, le volume du gaz et le nombre de moles sont directement proportionnels si la température et la pression sont constantes. Mathématiquement, il peut être exprimé avec l'équation suivante:
V / n = K
V = volume du gaz, généralement exprimé en litres.
n = quantité de substance mesurée en moles.
En outre, à partir de la loi dite des gaz parfaits, nous avons ce qui suit:
PV = nRT
P = la pression du gaz est généralement exprimée en atmosphères (atm), en mm de mercure (mmHg) ou en Pascal (Pa).
V = le volume du gaz exprimé en litres (L).
n = nombre de moles.
T = la température du gaz exprimée en degrés Celsius, degrés Fahrenheit ou degrés Kelvin (0 ºC équivaut à 273,15 K).
R = la constante universelle des gaz parfaits, qui peut être exprimée en différentes unités, parmi lesquelles se distinguent les suivantes: 0,08205 L atm / K. mol (L atm K-1.Môle-1); 8,314 J / K. mol (J.K-1.Môle-1) (J est joule); et 1,987 cal / Kmol (cal.K-1.Môle-1) (cal est des calories).
Déduction de la valeur de R lorsqu'elle est exprimée en LAtm / KTaupe
Le volume qu’occupe une mole de gaz à une atmosphère de pression et de 0 ºC équivalent à 273K est de 22,414 litres.
R = PV / T
R = 1 atm x 22414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
L'équation des gaz parfaits (PV = nRT) peut s'écrire comme suit:
V / n = RT / P
Si la température et la pression sont supposées constantes, parce que R est une constante, alors:
RT / P = K
Alors:
V / n = K
C'est une conséquence de la loi d'Avogadro: l'existence d'une relation constante entre le volume qu'occupe un gaz parfait et le nombre de moles de ce gaz, pour une température et une pression constantes..
Forme habituelle de la loi d'Avogadro
Si vous avez deux gaz, l'équation ci-dessus devient la suivante:
V1/ n1= Vdeux/ ndeux
Cette expression s'écrit également:
V1/ Vdeux= n1/ ndeux
Ce qui précède montre la relation de proportionnalité indiquée.
Dans son hypothèse, Avogadro a souligné que deux gaz idéaux dans le même volume et à la même température et pression contiennent le même nombre de molécules.
Par extension, il en va de même pour les gaz réels; par exemple, un volume égal d'Odeux et ndeux contient le même nombre de molécules lorsqu'il est à la même température et pression.
Les gaz réels montrent de petits écarts par rapport au comportement idéal. Cependant, la loi d'Avogadro est approximativement valable pour des gaz réels à une pression suffisamment basse et à des températures élevées..
Conséquences et implications
La conséquence la plus significative de la loi d'Avogadro est que la constante R pour les gaz parfaits a la même valeur pour tous les gaz.
R = PV / nT
Donc si R est constant pour deux gaz:
P1V1/ NT1= PdeuxVdeux/ ndeuxTdeux = constante
Les suffixes 1 et 2 représentent deux gaz parfaits différents. La conclusion est que la constante de gaz idéal pour 1 mole d'un gaz est indépendante de la nature du gaz. Ensuite, le volume occupé par cette quantité de gaz à une température et une pression données sera toujours le même.
Une conséquence de l'application de la loi d'Avogadro est la constatation qu'une mole d'un gaz occupe un volume de 22 414 litres à une pression de 1 atmosphère et à une température de 0 ºC (273 K).
Une autre conséquence évidente est la suivante: si la pression et la température sont constantes, lorsque la quantité d'un gaz augmente, son volume augmente également..
origines
En 1811, Avogadro a avancé son hypothèse basée sur la théorie atomique de Dalton et la loi de Gay-Lussac sur les vecteurs de mouvement des molécules..
Gay-Lussac concluait en 1809 que "les gaz, quelles que soient les proportions dans lesquelles ils peuvent être combinés, donnent toujours naissance à des composés dont les éléments mesurés en volume sont toujours des multiples d'un autre".
Le même auteur a également montré que "les combinaisons de gaz s'effectuent toujours selon des relations très simples en volume".
Avogadro a souligné que les réactions chimiques en phase gazeuse impliquent des espèces moléculaires à la fois des réactifs et du produit.
Selon cette déclaration, la relation entre le réactif et les molécules de produit doit être un nombre entier, car l'existence d'une rupture de liaison avant la réaction (atomes individuels) n'est pas probable. Cependant, les quantités molaires peuvent être exprimées avec des valeurs fractionnaires.
De son côté, la loi des volumes de combinaison indique que la relation numérique entre les volumes gazeux est également simple et entière. Il en résulte une association directe entre les volumes et le nombre de molécules de l'espèce gazeuse..
Hypothèse d'Avogadro
Avogadro a proposé que les molécules de gaz soient diatomiques. Cela explique comment deux volumes d'hydrogène moléculaire se combinent avec un volume d'oxygène moléculaire pour donner deux volumes d'eau..
En outre, Avogadro a proposé que si des volumes égaux de gaz contenaient le même nombre de particules, la relation entre les densités des gaz devrait être égale à la relation entre les masses moléculaires de ces particules..
Evidemment, diviser d1 par d2 donne lieu au quotient m1 / m2, puisque le volume occupé par les masses gazeuses est le même pour les deux espèces et il s'annule:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Numéro d'Avogadro
Une mole contient 6,022 x 102. 3 molécules ou atomes. Ce chiffre s'appelle le numéro d'Avogadro, bien que ce ne soit pas lui qui l'a calculé. Jean Pierre, prix Nobel de 1926, a fait les mesures correspondantes et a suggéré le nom en l'honneur d'Avogadro.
L'expérience d'Avogadro
Une démonstration très simple de la loi d'Avogadro consiste à placer de l'acide acétique dans une bouteille en verre puis à ajouter du bicarbonate de sodium, en fermant l'embouchure de la bouteille avec un ballon qui empêche l'entrée ou la sortie d'un gaz de l'intérieur de la bouteille..
L'acide acétique réagit avec le bicarbonate de sodium, libérant ainsi du COdeux. Le gaz s'accumule dans le ballon provoquant son gonflage. Théoriquement, le volume atteint par le ballon est proportionnel au nombre de molécules de COdeux, comme indiqué par la loi d'Avogadro.
Cependant, cette expérience a une limite: le ballon est un corps élastique; par conséquent, à mesure que sa paroi s'étire en raison de l'accumulation de COdeux, une force est générée en cela qui s'oppose à sa distension et tente de réduire le volume du ballon.
Expérimentez avec des conteneurs commerciaux
Une autre expérience illustrative de la loi d'Avogadro est présentée avec l'utilisation de canettes de soda et de bouteilles en plastique..
Dans le cas des canettes de soda, du bicarbonate de soude y est versé, puis une solution d'acide citrique est ajoutée. Les composés réagissent les uns avec les autres produisant la libération de gaz COdeux, qui s'accumule à l'intérieur de la canette.
Ensuite, une solution concentrée d'hydroxyde de sodium est ajoutée, qui a pour fonction de "séquestrer" le CO.deux. L'accès à l'intérieur de la canette est ensuite rapidement fermé à l'aide de ruban de masquage.
Après un certain temps, on observe que la boîte se contracte, indiquant que la présence de CO a diminué.deux. Ensuite, on pourrait penser qu'il y a une diminution du volume de la canette qui correspond à une diminution du nombre de molécules de CO.deux, selon la loi d'Avogadro.
Dans l'expérience avec la bouteille, la même procédure est suivie qu'avec la canette de soda, et lorsque le NaOH est ajouté, l'embouchure de la bouteille est fermée avec le couvercle; de même, une contraction de la paroi du flacon est observée. En conséquence, la même analyse peut être effectuée que dans le cas de la canette de soda..
Exemples
Les trois images ci-dessous illustrent le concept de la loi d'Avogadro, mettant en relation le volume qu'occupent les gaz et le nombre de molécules de réactifs et de produits..
OU ALORSdeux + 2Hdeux => 2HdeuxOU ALORS
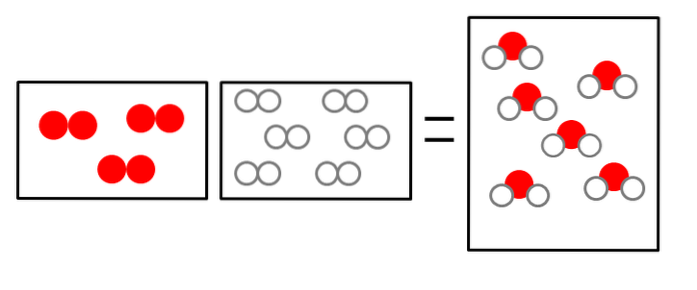
Le volume d'hydrogène gazeux est double, mais il occupe un récipient de la même taille que celui de l'oxygène gazeux.
Ndeux + 3Hdeux => 2NH3
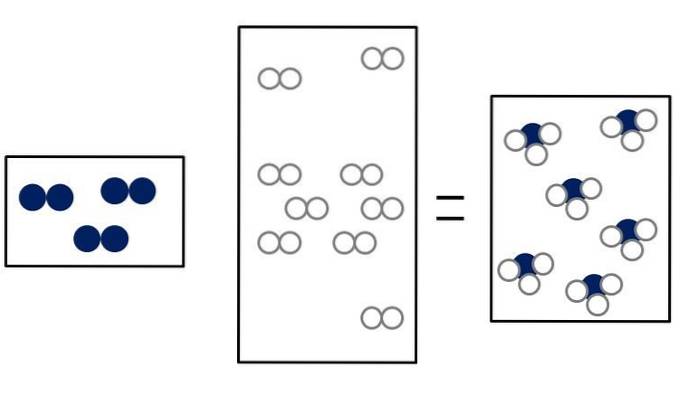
Ndeux + OU ALORSdeux => 2NON

Les références
- Bernard Fernandez, PhD. (Février 2009). Deux hypothèses d'Avogadro (1811). [PDF]. Tiré de: bibnum.education.fr
- Nuria Martínez Medina. (5 juillet 2012). Avogadro, le grand scientifique italien du 19e siècle. Tiré de: rtve.es
- Muñoz R. et Bertomeu Sánchez J.R. (2003) L'histoire de la science dans les manuels: hypothèse (s) d'Avogadro, Enseignement des sciences, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1er février 2018). Quelle est la loi d'Avogadro? Tiré de: thinkco.com
- Les rédacteurs de l'Encyclopaedia Britannica. (2016, 26 octobre). Loi d'Avogadro. Encyclopædia Britannica. Tiré de: britannica.com
- Yang, S. P. (2002). Produits ménagers utilisés pour fermer les conteneurs et démontrer la loi d'Avogadro. Éducateur en chimie. Vol: 7, pages: 37-39.
- Glasstone, S. (1968). Traité de chimie physique. deuxdonne Ed. Éditorial Aguilar.

Personne n'a encore commenté ce post.