
Histoire du droit de Boyle-Mariotte, expression, exemples
La loi de Boyle-Mariotte C'est celui qui exprime la relation entre la pression exercée par ou sur un gaz et le volume qu'il occupe; maintenir à la fois la température du gaz constante, ainsi que sa quantité (nombre de moles).
Cette loi, avec celle de Charles, Gay-Lussac, Charles et Avogadro, décrit le comportement d'un gaz parfait; en particulier, dans un récipient fermé soumis à des changements de volume exercés par une force mécanique.
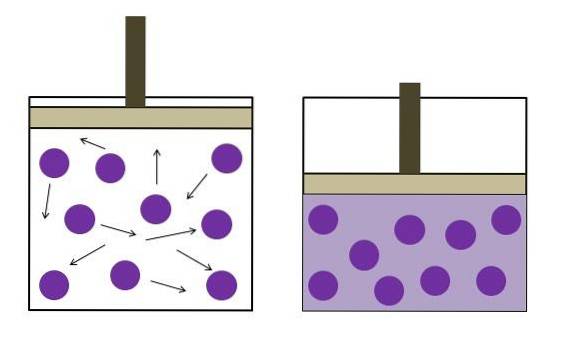
L'image ci-dessus résume brièvement la loi Boyle-Mariotte.
Les points violets représentent des molécules de gaz ou des atomes, qui entrent en collision avec les parois internes du conteneur (à gauche). À mesure que l'espace ou le volume disponible du conteneur occupé par ce gaz diminue, les collisions augmentent, ce qui se traduit par une augmentation de la pression (à droite).
Ceci montre que la pression P et le volume V du gaz sont inversement proportionnels si le récipient est fermé hermétiquement; sinon, une pression plus élevée équivaudrait à une plus grande expansion de la cuve.
Si un graphique V contre P était fait, avec les données de V et P sur les axes Y et X, respectivement, une courbe asymptotique serait observée. Plus le V est bas, plus l'augmentation de P est importante; c'est-à-dire que la courbe s'étendra vers des valeurs élevées de P sur l'axe X.
Bien entendu, la température reste constante; mais, si la même expérience était effectuée à des températures différentes, les positions relatives de ces courbes V vs P changeraient sur l'axe cartésien. Le changement serait encore plus évident s'il était tracé sur un axe tridimensionnel, avec T constante sur l'axe Z..
Index des articles
- 1 Histoire de la loi de Boyle
- 1.1 Contexte
- 1.2 Expérience sur le mercure
- 1.3 Edme Mariotte
- 1.4 Renforcement de la loi
- 2 Quelle est cette loi?
- 3 Expression mathématique
- 4 A quoi ça sert? Quels problèmes la loi de Boyle résout-elle??
- 4.1 Machines à vapeur
- 4.2 Siroter des boissons
- 4.3 Système respiratoire
- 5 Exemples (expériences)
- 5.1 Expérience 1
- 5.2 Expérience 2
- 6 Références
Histoire de la loi de Boyle
Antécédents
Depuis que le scientifique Galileo Galilei a exprimé sa croyance en l'existence d'un vide (1638), les scientifiques ont commencé à étudier les propriétés de l'air et des vides partiels..
Le chimiste anglo-irlandais, Robert Boyle, a commencé son étude des propriétés de l'air en 1638 en apprenant qu'Otto von Guericke, un ingénieur et physicien allemand, avait construit une pompe à air..
Expérience sur le mercure
Pour mener ses études sur la pression de l'air, Boyle a utilisé un tube de verre en forme de «J», dont la construction a été attribuée à Robert Hooke, un assistant de Boyle. L'extrémité du bras court était scellée, tandis que l'extrémité du bras long du tube était ouverte pour placer le mercure.
Dès le début, Boyle a voulu étudier l'élasticité de l'air, qualitativement et quantitativement. En versant du mercure à travers l'extrémité ouverte du tube en «J», Boyle a déduit que l'air dans le bras court du tube se contractait sous la pression du mercure..
Résultats
Plus la quantité de mercure ajoutée au tube est élevée, plus la pression exercée sur l'air est élevée et plus son volume est petit. Boyle a obtenu un graphique de type exponentiel négatif du volume d'air en fonction de la pression.
Pendant ce temps, si le volume d'air est tracé par rapport à l'inverse de la pression, nous avons une ligne droite avec une pente positive.
En 1662, Boyle a publié la première loi physique qui a été donnée sous la forme d'une équation, qui indiquait la dépendance fonctionnelle de deux variables. Dans ce cas, la pression et le volume.
Boyle a souligné qu'il y avait une relation inverse entre la pression exercée sur un gaz et le volume occupé par le gaz, cette relation étant relativement vraie pour les gaz réels. La plupart des gaz se comportent comme des gaz idéaux à des températures et des pressions modérées.
À mesure que des pressions plus élevées et des températures plus basses se produisaient, les écarts dans le comportement des gaz réels par rapport aux idéaux devenaient plus visibles..
Edme Mariotte
Le physicien français Edme Mariotte (1620-1684) a découvert indépendamment la même loi en 1679. Mais elle avait le mérite de montrer que le volume varie avec la température. C'est pourquoi on l'appelle la loi de Mariotte ou la loi de Boyle et Mariotte..
Renforcement de la loi
Daniel Bernoulli (1737) a renforcé la loi de Boyle en soulignant que la pression d'un gaz est produite par les impacts de particules de gaz sur les parois du récipient qui le contient..
En 1845, John Waterston publie un article scientifique dans lequel il se concentre sur les grands principes de la théorie cinétique des gaz..
Plus tard, Rudolf Clausius, James Maxwell et Ludqwig Boltzmann ont consolidé la théorie cinétique des gaz, qui met en relation la pression exercée par un gaz avec la vitesse des particules de gaz en mouvement..
Plus le volume du récipient contenant un gaz est petit, plus la fréquence des impacts des particules qui le forment contre les parois du récipient est élevée; et donc, plus la pression exercée par le gaz est élevée.
Quelle est cette loi?
Les expériences menées par Boyle indiquent qu'il existe une relation inverse entre le volume occupé par un gaz et la pression exercée sur celui-ci. Cependant, la relation indiquée n'est pas totalement linéaire, comme l'indique un graphique de la variation du volume en fonction de la pression attribuée à Boyle.
La loi de Boyle indique que le volume occupé par un gaz est inversement proportionnel à la pression. Il est également indiqué que le produit de la pression d'un gaz et de son volume est constant.
Expression mathématique
Pour arriver à l'expression mathématique de la loi de Boyle-Mariotte, on part de:
V ∝ 1 / P
Où indique que le volume occupé par un gaz est inversement proportionnel à sa pression. Cependant, il existe une constante qui dicte à quel point cette relation est inversement proportionnelle.
V = k / P
Où k est la constante de proportionnalité. En résolvant pour k, nous avons:
VP = k
Le produit de la pression d'un gaz et de son volume est constant. Ensuite:
V1P1 = k et VdeuxPdeux = k
Et de cela, on peut en déduire que:
V1P1 = VdeuxPdeux
Cette dernière est l'expression ou l'équation finale de la loi de Boyle.
Pourquoi est-ce? Quels problèmes la loi de Boyle résout-elle??
Machines à vapeur

La loi Boyle-Mariotte est appliquée au fonctionnement des machines à vapeur. C'est un moteur à combustion externe qui utilise la transformation de l'énergie thermique d'une quantité d'eau en énergie mécanique.
L'eau est chauffée dans une chaudière hermétiquement fermée, et la vapeur produite exerce une pression selon la loi de Boyle-Mariote qui produit une expansion de volume d'un cylindre en poussant un piston.
Le mouvement linéaire du piston se transforme en mouvement de rotation, grâce à l'utilisation d'un système de bielles et de manivelles, qui peut entraîner les roues d'une locomotive ou le rotor d'un générateur électrique..
Actuellement, la machine à vapeur alternative est un moteur peu utilisé, car elle a été déplacée par le moteur électrique et par le moteur à combustion interne dans les véhicules de transport..
Sirotez des boissons
L'action de sucer une boisson gazeuse ou un jus d'une bouteille à travers un tube en plastique est liée à la loi Boyle-Mariotte. Lorsque l'air est aspiré hors du tube en utilisant la bouche, il y a une diminution de la pression à l'intérieur du tube.
Cette perte de charge facilite le mouvement ascendant du liquide dans le tube, permettant son ingestion. Ce même principe fonctionne pour prélever du sang grâce à l'utilisation d'une seringue..
Système respiratoire
La loi de Boyle-Mariotte est étroitement liée au fonctionnement du système respiratoire. Pendant la phase d'inspiration, le diaphragme et les autres muscles se contractent; par exemple, les intercostales externes qui produisent une expansion de la cage thoracique.
Cela provoque une diminution de la pression intrapleurale, provoquant une expansion pulmonaire qui produit une augmentation du volume pulmonaire. Par conséquent, la pression intrapulmonaire diminue selon la loi de Boyle-Mariotte.
Lorsque la pression intrapulmonaire devient inférieure à la pression atmosphérique, l'air atmosphérique s'écoule dans les poumons, provoquant une augmentation de la pression dans les poumons; assimilant ainsi sa pression à la pression atmosphérique, et concluant la phase d'inspiration.
Par la suite, les muscles inspiratoires se relâchent et les muscles expiratoires se contractent. De plus, il se produit une rétraction pulmonaire élastique, phénomène qui produit une diminution du volume pulmonaire, avec une augmentation conséquente de la pression intrapulmonaire, expliquée par la loi de Boyle-Mariotte..
À mesure que la pression intrapulmonaire augmente et devient supérieure à la pression atmosphérique, l'air circule de l'intérieur des poumons vers l'atmosphère. Cela se produit jusqu'à ce que les pressions s'égalisent, ce qui conclut la phase d'expiration..
Exemples (expériences)
Expérience 1
Un petit ballon hermétiquement fermé est placé, faisant un nœud dans sa bouche, à l'intérieur d'une seringue, à partir de laquelle le piston a été retiré, d'environ 20 ml. Le piston de la seringue est placé vers le milieu de la seringue, l'aiguille est retirée et l'entrée d'air est obstruée.
Observation
En tirant lentement sur le piston de l'injecteur, on observe que le ballon se gonfle.
Explication
Deux pressions sont exercées sur la paroi du ballon: une pression sur sa face interne, un produit de l'air contenu à l'intérieur du ballon, et une autre pression sur la face externe du ballon, exercée par l'air contenu dans la seringue..
Le fait de tirer sur le piston de l'injecteur crée un demi-vide à l'intérieur. Par conséquent, la pression d'air sur la face externe de la paroi de la pompe diminue, ce qui rend la pression exercée à l'intérieur de la pompe relativement plus élevée..
Cette pression nette, selon la loi de Boyle-Mariote, produira une distension de la paroi du ballon et une augmentation du volume du ballon..
Expérience 2
Une bouteille en plastique est coupée environ en deux, garantissant que la coupe est aussi horizontale que possible. Un ballon bien ajusté est placé dans l'embouchure de la bouteille, en même temps une certaine quantité d'eau est placée dans une assiette creuse.
Observation
En plaçant le fond de la bouteille avec le ballon au-dessus de l'eau dans le plat, le ballon gonfle modérément.
Explication
L'eau déplace une certaine quantité d'air, augmentant la pression d'air sur la paroi de la bouteille et à l'intérieur du ballon. Ceci provoque, selon la loi de Boyle-Mariotte, une augmentation du volume du ballon, qui se visualise par le gonflage du ballon..
Les références
- Wikipédia. (2019). La loi de Boyle. Récupéré de: en.wikipedia.org
- Les rédacteurs de l'Encyclopaedia Britannica. (27 juillet 2018). La loi de Boyle. Encyclopædia Britannica. Récupéré de: britannica.com
- Helmenstine, Todd. (5 décembre 2018). La formule de la loi de Boyle. Récupéré de: thinkco.com
- Jeunes films indiens. (15 mai 2018). Loi de Boyle: expérience scientifique pour les enfants. Récupéré de: yifindia.com
- Cecilia Bembibre. (22 mai 2011). Montgolfière. Définition ABC. Récupéré de: definicionabc.com
- Ganong, W., F. (2003). Physiologie médicale. (19e édition). Éditorial du manuel moderne.



Personne n'a encore commenté ce post.