
Caractéristiques du modèle atomique de Schrödinger, postulats

le Modèle atomique de Schrödinger a été développé par Erwin Schrödinger en 1926. Cette proposition est connue sous le nom de modèle de mécanique quantique de l'atome et décrit le comportement ondulatoire de l'électron.

Schrödinger a suggéré que le mouvement des électrons dans l'atome correspondait à la dualité onde-particule, et par conséquent, les électrons pouvaient se déplacer autour du noyau sous forme d'ondes stationnaires..
Schrödinger, qui a reçu le prix Nobel en 1933 pour ses contributions à la théorie atomique, a développé l'équation du même nom pour calculer la probabilité qu'un électron se trouve dans une position spécifique..
Index des articles
- 1 Caractéristiques du modèle atomique de Schrödinger
- 2 expérience
- 2.1 Expérience de Young: la première démonstration de la dualité onde-particule
- 2.2 L'équation de Schrödinger
- 3 postulats
- 4 Articles d'intérêt
- 5 Références
Caractéristiques du modèle atomique de Schrödinger
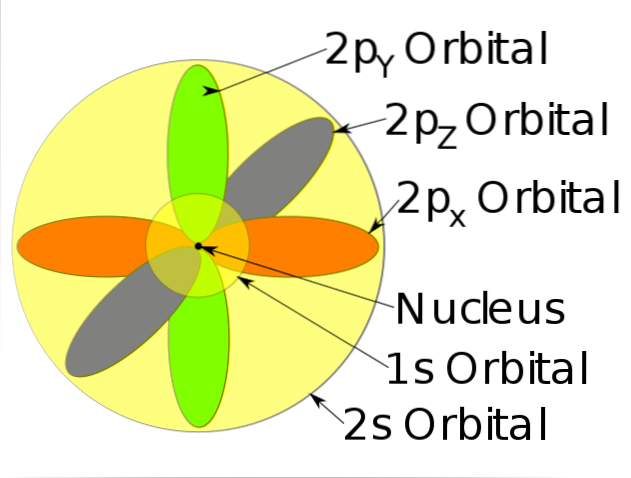
-Décrivez le mouvement des électrons comme des ondes stationnaires.
-Les électrons se déplacent constamment, c'est-à-dire qu'ils n'ont pas de position fixe ou définie dans l'atome.
-Ce modèle ne prédit pas l'emplacement de l'électron, ni ne décrit le chemin qu'il emprunte à l'intérieur de l'atome. Établissez simplement une zone de probabilité pour localiser l'électron.
-Ces zones de probabilité sont appelées orbitales atomiques. Les orbitales décrivent un mouvement de translation autour du noyau de l'atome.
-Ces orbitales atomiques ont différents niveaux d'énergie et sous-niveaux, et peuvent être définies entre des nuages d'électrons.
-Le modèle ne considère pas la stabilité du noyau, il se réfère uniquement à l'explication de la mécanique quantique associée au mouvement des électrons à l'intérieur de l'atome..

Expérience
Le modèle atomique de Schrödinger est basé sur l'hypothèse de Broglie, ainsi que sur les modèles atomiques précédents de Bohr et Sommerfeld.
Broglie a proposé que tout comme les ondes ont des propriétés de particules, les particules ont des propriétés d'ondes, ayant une longueur d'onde associée. Quelque chose qui a suscité beaucoup d'attentes à l'époque, étant Albert Einstein lui-même approuvant sa théorie.
Cependant, la théorie de Broglie avait un défaut, qui était que le sens de l'idée elle-même n'était pas bien compris: un électron peut être une onde, mais de quoi? C'est alors que la figure de Schrödinger semble donner une réponse.
Pour ce faire, le physicien autrichien s'est appuyé sur l'expérience de Young, et sur la base de ses propres observations, il a développé l'expression mathématique qui porte son nom.
Voici les fondements scientifiques de ce modèle atomique:
Expérience de Young: la première démonstration de la dualité onde-particule
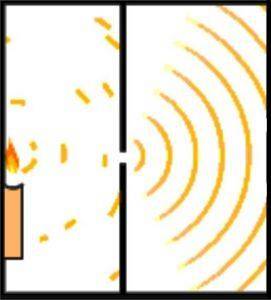
L'hypothèse de Broglie sur la nature ondulatoire et corpusculaire de la matière peut être démontrée à l'aide de l'expérience de Young, également connue sous le nom d'expérience à double fente..
Le scientifique anglais Thomas Young a jeté les bases du modèle atomique de Schrödinger quand, en 1801, il a mené l'expérience pour vérifier la nature ondulatoire de la lumière..
Au cours de son expérimentation, Young a divisé l'émission d'un faisceau de lumière passant à travers un petit trou à travers une chambre d'observation. Cette division est réalisée en utilisant une carte de 0,2 millimètre, située parallèlement au faisceau..
La conception de l'expérience a été conçue de manière à ce que le faisceau de lumière soit plus large que la carte, ainsi, en plaçant la carte horizontalement, le faisceau a été divisé en deux parties approximativement égales. La sortie des faisceaux lumineux était dirigée par un miroir.
Les deux faisceaux de lumière ont frappé un mur dans une pièce sombre. Là, le diagramme d'interférence entre les deux ondes a été mis en évidence, ce qui a démontré que la lumière pouvait se comporter à la fois comme une particule et comme une onde..
Un siècle plus tard, Albert Einsten a renforcé l'idée en utilisant les principes de la mécanique quantique..
L'équation de Schrödinger
Schrödinger a développé deux modèles mathématiques, différenciant ce qui se passe selon que l'état quantique change avec le temps ou non.
Pour l'analyse atomique, Schrödinger a publié l'équation de Schrödinger indépendante du temps à la fin de 1926, qui est basée sur le fait que les fonctions d'onde se comportent comme des ondes stationnaires..
Cela implique que l'onde ne bouge pas, ses nœuds, c'est-à-dire ses points d'équilibre, servent de pivot au reste de la structure pour se déplacer autour d'eux, décrivant une fréquence et une amplitude spécifiques..
Schrödinger a défini les ondes qui décrivent les électrons comme des états stationnaires ou orbitaux, et elles sont associées, à leur tour, à différents niveaux d'énergie.
L'équation de Schrödinger indépendante du temps est la suivante:
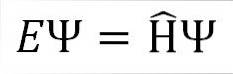
Où:
ET: constante de proportionnalité.
Ψ: fonction d'onde du système quantique.
Η ̂: Opérateur hamiltonien.
L'équation de Schrödinger indépendante du temps est utilisée lorsque l'observable représentant l'énergie totale du système, connue sous le nom d'opérateur hamiltonien, ne dépend pas du temps. Cependant, la fonction qui décrit le mouvement total des vagues dépendra toujours du temps..
L'équation de Schrödinger indique que si nous avons une fonction d'onde Ψ, et que l'opérateur hamiltonien agit sur elle, la constante de proportionnalité E représente l'énergie totale du système quantique dans l'un de ses états stationnaires.
Appliqué au modèle atomique de Schrödinger, si l'électron se déplace dans un espace défini, il y a des valeurs d'énergie discrètes, et si l'électron se déplace librement dans l'espace, il y a des intervalles d'énergie continus.
Du point de vue mathématique, il existe plusieurs solutions pour l'équation de Schrödinger, chaque solution implique une valeur différente pour la constante de proportionnalité E.
Selon le principe d'incertitude de Heisenberg, il n'est pas possible d'estimer la position et l'énergie d'un électron. Par conséquent, les scientifiques reconnaissent que l'estimation de l'emplacement de l'électron dans l'atome est inexacte..
Postulats
Les postulats du modèle atomique de Schrödinger sont les suivants:
-Les électrons se comportent comme des ondes stationnaires qui sont distribuées dans l'espace selon la fonction d'onde Ψ.
-Les électrons se déplacent à l'intérieur de l'atome en orbitales. Ce sont des domaines où la probabilité de trouver un électron est considérablement plus élevée. La probabilité référencée est proportionnelle au carré de la fonction d'onde Ψdeux.
La configuration électronique du modèle atomique de Schrödinguer explique les propriétés périodiques des atomes et les liaisons qu'ils forment.
Cependant, le modèle atomique de Schrödinger ne tient pas compte du spin des électrons, ni des variations du comportement des électrons rapides dues aux effets relativistes..
Articles d'intérêt
Modèle Atomic de Broglie.
Modèle atomique de Chadwick.
Modèle atomique de Heisenberg.
Le modèle atomique de Perrin.
Le modèle atomique de Thomson.
Modèle atomique de Dalton.
Modèle atomique de Dirac Jordan.
Modèle atomique de Démocrite.
Modèle atomique de Leucippe.
Modèle atomique de Bohr.
Modèle atomique de Sommerfeld.
Modèle atomique actuel.
Les références
- Modèle atomique de Schrodinger (2015). Récupéré de: quimicas.net
- Le modèle de mécanique quantique de l'atome Récupéré de: en.khanacademy.org
- Équation d'onde de Schrödinger (s.f.). Université Jaime I. Castellón, Espagne. Récupéré de: uji.es
- Théorie atomique moderne: modèles (2007). © ABCTE. Récupéré de: abcte.org
- Modèle atomique de Schrödinger (s.f.). Récupéré de: erwinschrodingerbiography.weebly.com
- Wikipédia, l'encyclopédie libre (2018). Équation de Schrödinger. Récupéré de: es.wikipedia.org
- Wikipédia, l'encyclopédie libre (2017). L'expérience de Young. Récupéré de: es.wikipedia.org



Personne n'a encore commenté ce post.