
Concentration molaire, unités, calcul, exercices
La molarité est la concentration d'une solution exprimée en moles de soluté par litre de solution. Il est abrégé en M et exprime une relation entre la masse du soluté et le volume de la solution (m / v); bien que traditionnellement cette relation soit exprimée en poids / volume.
Une mole est le nombre d'atomes ou de molécules contenus dans le poids atomique ou moléculaire; Il est exprimé en grammes / mole. Une mole équivaut à 6,02 · 102. 3 atomes ou molécules, connus sous le nom de nombre d'Avogadro.
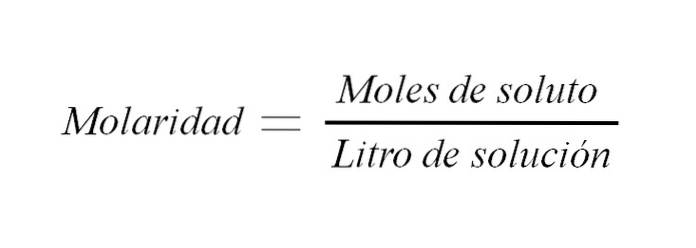
Il existe d'autres moyens d'exprimer la relation entre la masse d'un soluté et le volume, notamment: la relation en pourcentage entre la masse du soluté et le volume de la solution, et la normalité. Ce dernier est exprimé en nombre d'équivalents d'un soluté par litre de solution.
Pendant ce temps, la molalité, qui est définie comme le nombre de moles par kilogramme de solvant, généralement de l'eau, exprime une relation entre la masse du soluté et la masse du solvant (m / m)..
La forme d'expression de la concentration d'une solution en parties par million (ppm), exprime une relation entre une partie du soluté et un million de parties de la solution, étant généralement utilisée pour exprimer une relation masse-masse (m / m) . Mais vous pouvez exprimer une relation masse-volume (m / v).
La concentration molaire, en plus d'être exprimée en moles par litre, peut être exprimée en millimoles / litre (solution millimolaire); micromoles / litre (solution micromolaire); etc.
Les problèmes de molarité peuvent être résolus en utilisant une méthode analytique et en utilisant la "règle de trois". Le choix d'une méthode dépendra de la compétence que vous avez dans l'utilisation de l'une des méthodes.
Index des articles
- 1 concentration molaire
- 2 unités
- 3 Comment calculer la molarité?
- 4 Passer de la molarité à la molalité
- 4.1 Première étape
- 4.2 Deuxième étape
- 4.3 Troisième étape
- 4.4 Quatrième étape
- 4.5 Cinquième étape
- 4.6 Exemple numérique
- 5 problèmes résolus
- 5.1 Problème 1
- 5.2 Problème 2
- 5.3 Problème 3
- 5.4 Problème 4
- 5.5 Problème 5
- 6 Références
Concentration molaire
Il est utilisé pour exprimer la concentration d'un soluté dans un volume de solution donné.
M = n / V (1)
Où M est égal à la molarité, n est le nombre de moles et V est le volume de la solution. Ainsi, la molarité d'une solution est le nombre de moles de soluté par volume de solution exprimé en litres.
D'autre part, le nombre de grains de beauté est
n = m / PM (2)
Où m est la masse du soluté dissous et PM sa masse molaire.
Remplacer (2) dans (1):
M = (m / PM) / V
Unités
L'unité du système international de concentration molaire est mol / m3. Cela correspond à une solution millimolaire, car je suis3 équivaut à 1 000 litres. Dans les branches de la chimie et de la biologie, la concentration molaire est généralement exprimée en moles / L. Cette unité est exprimée par le M (majuscule).
Une solution d'une mole / L équivaut à une solution M; une solution de 10-3 moles / L, équivaut à 1 mM (millimolaire); et une solution de 10-6 moles / L, équivaut à 1µM (micromolaire).
Comment calculer la molarité?
Il est pratique d'utiliser les expressions indiquées ci-dessus, car cela garantit que le résultat de l'application de la formule donnera en moles / litres, qui est la définition de la concentration molaire.
Ensuite, pour calculer la molarité d'une solution, il faut exprimer la concentration du soluté en g / L. Puis trouver le poids moléculaire du soluté (g / mol) et trouver le rapport entre la concentration et le poids moléculaire. Le résultat obtenu est la molarité exprimée en moles / litre.
Passer de la molarité à la molalité
Une information nécessaire pour passer de la molarité à la molalité est de connaître la densité de la solution. Cela permet de connaître la masse de la solution, condition essentielle pour le calcul de la molalité..
Premier pas
Il faut d'abord passer de la concentration molaire aux grammes / litres. Pour ce faire, il suffit de multiplier la molarité de la solution par le poids moléculaire du soluté..
Grammes / litre de soluté = molarité (moles / litre) · poids moléculaire du soluté (grammes / mole).
Cela permet d'obtenir la masse du soluté dans 1 L de solution.
Deuxième pas
Ensuite, il est nécessaire de calculer la masse de la solution. Pour cela, la densité de celui-ci est utilisée. Habituellement, la densité est exprimée en grammes / centimètre cube ou millilitre.
Masse de la solution (g) = volume de la solution (mL) densité (g / mL)
Troisième étape
Obtention de la masse du solvant. La masse de la solution étant égale à la masse du soluté plus la masse du solvant, pour obtenir la masse de ce dernier, il suffit de soustraire la masse du soluté (étape 1) de la masse de la solution ( étape 2)..
Quatrième étape
Enfin, la masse de soluté (g) de la solution doit être transférée à la masse de soluté qui correspond à 1 000 g ou 1 kg de solvant. Pour ce faire, il suffirait d'effectuer une simple règle de trois ou une autre opération mathématique équivalente.
Cinquième étape
Diviser g de soluté / 1000 g de solvant par le poids moléculaire du soluté (g / mol) pour obtenir la molalité de la solution.
Exemple numérique
Une solution de glucose 3 M (poids moléculaire 180 g / mol) a une densité de 1,15 g / mL. Calculer la molalité de cette solution.
Nous calculons d'abord les grammes de glucose dissous dans un litre de solution:
g / L = 3 moles / L 180 g / mol
= 540 g / L
Ensuite, nous calculons la masse de la solution à partir de sa densité:
g de solution (masse) = 1000 mL 1,15 g / mL
= 1 150 g
La masse de solvant est donnée par la différence:
Masse de solvant = masse de solution - masse de soluté
= 1 150 g - 540 g
= 610 g
Mais 610 g n'est pas 1000 g de solvant comme le stipule la définition de la molalité. Par conséquent, il faut calculer combien de grammes de glucose sont dissous dans 1000 g de solvant:
Masse de soluté = 540 g de soluté (1000 g de solvant / 610 g de solvant)
= 885,25 g
Et enfin la molalité est calculée en retournant les grammes en moles:
Molalité = (885,25 g de soluté / 180 g / mol)
= 4,92 mol de soluté / kg de solvant
= 4,92 m
Problèmes résolus
Problème 1
Combien de sulfate cuivrique faut-il pour préparer 500 mL d'une solution 0,4 M? Exprimez le résultat en grammes. Poids moléculaire du sulfate cuivrique (CuSO4): 160 g / mol.
Nous déterminons d'abord les grains de beauté qui doivent être dissous dans une telle solution:
M = n / V
n = M V
n = (0,4 mol / L) 0,5 L
= 0,2 mole
Connaissant alors le nombre de moles de sulfate cuivrique sa masse peut être obtenue
n = m / PM
m = poids nanométrique
m = 0,2 mol 160 g / mol
= 32 g de CuSO4
Autrement dit, 32 grammes de ce sel doivent être dissous dans 500 ml de solvant.
Problème 2
Quel volume de solution est nécessaire pour que lorsque 0,4 mole de soluté se dissout, il ait une concentration de 0,25 M?
Le volume de la solution est obtenu à partir du concept de molarité
M = n / V
V = n / M
V = 0,4 mole / (0,25 mole / L)
= 1,6 L
Cela signifie que la solution doit avoir un volume de 1,6 litre pour obtenir une telle concentration de 0,25 M.
Problème 3
Une masse de 8 g d'hydroxyde de sodium (NaOH) est dissoute dans 60 g d'une solution de densité 1,6 g / mL. Quelle sera la molarité de la solution? Masse moléculaire de l'hydroxyde de sodium: 40 g / mol.
Les moles de NaOH doivent d'abord être calculées:
n = m / PM
= 8 g d'hydroxyde de sodium / (40 g / mol)
= 0,2 mole
Nous procédons maintenant au calcul du volume de la solution:
m = V d
v = 60 g / (1,6 g / ml)
v = 37,5 ml
Pour obtenir la molarité, le volume de la solution en litres doit être placé:
V = 37,5 ml10-3 L / mL
= 0,0375 L
M = 0,2 mole / 0,0375 L
5,33 moles / L
5,33 millions
Problème 4
Calculez la molarité d'une solution d'acide chlorhydrique (HCl) avec une densité de 1,25 g / mL et une concentration de 35%, exprimée en masse / masse. Poids moléculaire d'acide chlorhydrique: 36,5 g / mol.
Déterminer la masse d'acide chlorhydrique à 35%
m = V d
m = 1 000 ml 1,25 g / ml
= 1 250 g
Mais tout n'est pas HCl, il y a aussi de l'eau:
masse HCl = 1250 g (35/100)
= 437,5 g
Ce qui revient à dire que dans un litre de solution de HCl à 35%, il y a 437,5 grammes de HCl.
Ensuite, les moles de HCl sont calculées, pour déterminer immédiatement la molarité:
n = m / PM
n = (437,5 g / L) / (36,5 g / mol)
= 11,98 moles / L
Molarité = 11,98 M
Problème 5
Calculez la molarité d'une solution contenant 5 g de NaCl dans 2 L de solution. Poids moléculaire du chlorure de sodium: 58,5 g / mol.
Les moles / L de NaCl peuvent être obtenus en une seule étape:
molarité = (5 g NaCl / 2 L solution) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol / L
Molarité = 0,043 M
Une autre procédure pourrait être:
g / L NaCl = 5 g / 2 L
= 2,5 g / L
moles / L = (2,5 g / L) / (58,5 g / mol)
= 0,043 mol / L
= 0,043 M
Les références
- Rodríguez, M. (2007). Chimie. Fondation éditoriale salésienne
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2019). Molarité Récupéré de: es.wikipedia.org
- Atarés Huerta. (s.f.). Molarité et molalité. [PDF]. Récupéré de: riunet.upv.es
- Softchools. (2019). Formule de molarité. Récupéré de: softschools.com


Personne n'a encore commenté ce post.