
Formules de machines Carnot, fonctionnement et applications

La machine à carnot c'est un modèle cyclique idéal dans lequel la chaleur est utilisée pour travailler. Le système peut être compris comme un piston qui se déplace à l'intérieur d'un cylindre comprimant un gaz. Le cycle exercé est celui de Carnot, énoncé par le père de la thermodynamique, le physicien et ingénieur français Nicolas Léonard Sadi Carnot..
Carnot a énoncé ce cycle au début du XIXe siècle. La machine est soumise à quatre variations d'état, des conditions alternées telles que la température et la pression constante, où une variation du volume est mise en évidence lors de la compression et de l'expansion du gaz.
Index des articles
- 1 Formules
- 1.1 Expansion isotherme (A → B)
- 1.2 Expansion adiabatique (B → C)
- 1.3 Compression isotherme (C → D)
- 1.4 Compression adiabatique (D → A)
- 2 Comment fonctionne la machine Carnot?
- 3 applications
- 4 Références
Formules
Selon Carnot, en soumettant la machine idéale à des variations de température et de pression, il est possible de maximiser les performances obtenues.
Le cycle de Carnot doit être analysé séparément dans chacune de ses quatre phases: expansion isotherme, expansion adiabatique, compression isotherme et compression adiabatique..
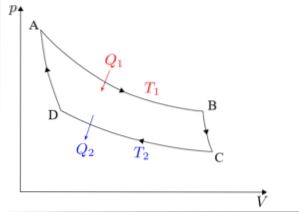
Les formules associées à chacune des phases du cycle réalisé dans la machine de Carnot seront détaillées ci-dessous..
Expansion isotherme (A → B)
Les prémisses de cette phase sont les suivantes:
- Volume de gaz: passe du volume minimum au volume moyen.
- Température de la machine: température constante T1, valeur élevée (T1> T2).
- Pression machine: chute de P1 à P2.
Le processus isotherme implique que la température T1 ne varie pas pendant cette phase. Le transfert de chaleur induit une expansion de gaz, ce qui induit un mouvement sur le piston et produit un travail mécanique.
Au fur et à mesure que le gaz se dilate, il a tendance à se refroidir. Cependant, il absorbe la chaleur émise par la source de température et pendant son expansion, il maintient la température constante..
Comme la température reste constante pendant ce processus, l'énergie interne du gaz ne change pas et toute la chaleur absorbée par le gaz est effectivement transformée en travail. A) Oui:
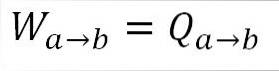
De son côté, à la fin de cette phase du cycle, il est également possible d'obtenir la valeur de pression à l'aide de l'équation des gaz parfaits. Ainsi, nous avons ce qui suit:
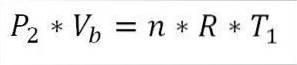
Dans cette expression:
Pdeux: Pression en fin de phase.
Vb: Volume au point b.
n: nombre de moles de gaz.
A: Constante universelle des gaz parfaits. R = 0,082 (atm * litre) / (moles * K).
T1: température absolue initiale, degrés Kelvin.
Expansion adiabatique (B → C)
Au cours de cette phase du processus, l'expansion du gaz a lieu sans qu'il soit nécessaire d'échanger de la chaleur. Ainsi, les locaux sont détaillés ci-dessous:
- Volume de gaz: passe du volume moyen au volume maximum.
- Température de la machine: baisse de T1 à T2.
- Pression de la machine: pression constante P2.
Le processus adiabatique implique que la pression P2 ne varie pas pendant cette phase. La température diminue et le gaz continue de se dilater jusqu'à ce qu'il atteigne son volume maximum; c'est-à-dire que le piston atteint la butée.
Dans ce cas, le travail effectué provient de l'énergie interne du gaz et sa valeur est négative car l'énergie diminue au cours de ce processus..
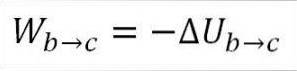
En supposant qu'il s'agisse d'un gaz idéal, la théorie soutient que les molécules de gaz n'ont que de l'énergie cinétique. Selon les principes de la thermodynamique, cela peut être déduit par la formule suivante:
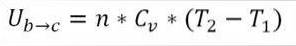
Dans cette formule:
∆Ub → c: Variation de l'énergie interne du gaz parfait entre les points b et c.
n: nombre de moles de gaz.
Cv: capacité thermique molaire du gaz.
T1: température absolue initiale, degrés Kelvin.
T2: température finale absolue, degrés Kelvin.
Compression isotherme (C → D)
Dans cette phase, la compression du gaz commence; c'est-à-dire que le piston pénètre dans le cylindre, avec lequel le gaz contracte son volume.
Les conditions inhérentes à cette phase du processus sont détaillées ci-dessous:
- Volume de gaz: passe du volume maximum au volume intermédiaire.
- Température machine: température constante T2, valeur réduite (T2 < T1).
- Pression machine: augmente de P2 à P1.
Ici, la pression sur le gaz augmente, il commence donc à se comprimer. Cependant, la température reste constante et, par conséquent, la variation d'énergie interne du gaz est nulle.
Analogue à l'expansion isotherme, le travail effectué est égal à la chaleur du système. A) Oui:
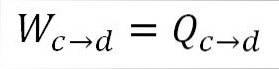
Il est également possible de trouver la pression à ce stade en utilisant l'équation du gaz parfait.
Compression adiabatique (D → A)
C'est la dernière phase du processus, dans laquelle le système revient à ses conditions initiales. Pour cela, les conditions suivantes sont considérées:
- Volume de gaz: passe d'un volume intermédiaire à un volume minimum.
- Température machine: augmente de T2 à T1.
- Pression machine: pression constante P1.
La source de chaleur incorporée au système lors de la phase précédente est supprimée, de sorte que le gaz idéal élève sa température tant que la pression reste constante..
Le gaz retourne aux conditions de température initiales (T1) et à son volume (minimum). Encore une fois, le travail effectué provient de l'énergie interne du gaz, il faut donc:
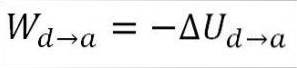
Similaire au cas de l'expansion adiabatique, il est possible d'obtenir la variation de l'énergie du gaz au moyen de l'expression mathématique suivante:
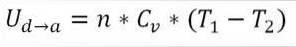
Comment fonctionne la machine Carnot?
Le moteur Carnot fonctionne comme un moteur dans lequel les performances sont maximisées en faisant varier les processus isothermes et adiabatiques, en alternant les phases de détente et de compression d'un gaz idéal..
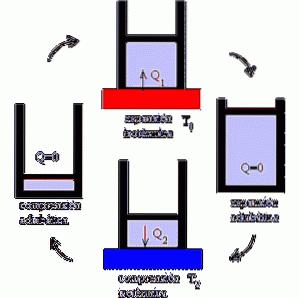
Le mécanisme peut être compris comme un appareil idéal qui effectue un travail soumis à des variations de chaleur, compte tenu de l'existence de deux sources de température.
Dans le premier foyer, le système est exposé à une température T1. C'est une température élevée qui met le système à rude épreuve et provoque l'expansion du gaz..
A son tour, cela se traduit par l'exécution d'un travail mécanique qui permet la mobilisation du piston hors du cylindre, et dont l'arrêt n'est possible que par détente adiabatique.
Vient ensuite le deuxième foyer, dans lequel le système est exposé à une température T2, inférieure à T1; c'est-à-dire que le mécanisme est soumis à un refroidissement.
Ceci induit l'extraction de la chaleur et l'écrasement du gaz, qui atteint son volume initial après compression adiabatique..
Applications
La machine Carnot a été largement utilisée grâce à sa contribution à la compréhension des aspects les plus importants de la thermodynamique.
Ce modèle permet une compréhension claire des variations des gaz parfaits soumis à des changements de température et de pression, ce qui en fait une méthode de référence lors de la conception de moteurs réels..
Les références
- Cycle du moteur thermique Carnot et la 2e loi (s.f.). Récupéré de: nptel.ac.in
- Castellano, G. (2018). Machine Carnot. Récupéré de: famaf.unc.edu.ar
- Cycle de Carnot (s.f.) Ecured. La Havane Cuba. Récupéré de: ecured.cu
- Le cycle de Carnot (s.f.). Récupéré de: sc.ehu.es
- Fowler, M. (s.f.). Moteurs thermiques: le cycle Carnot. Récupéré de: galileo.phys.virginia.edu
- Wikipédia, l'encyclopédie libre (2016). Machine Carnot. Récupéré de: es.wikipedia.org

Personne n'a encore commenté ce post.