
Formules, propriétés, utilisations et risques du nitrate d'aluminium
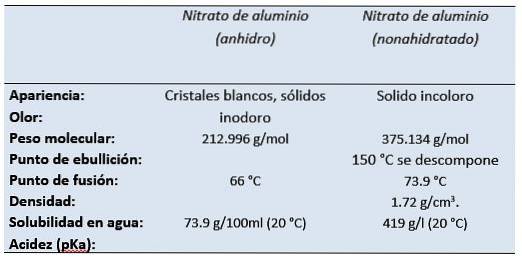
le nitrate d'aluminium C'est le sel d'aluminium de l'acide nitrique. Le nitrate d'aluminium nonahydraté, à température ambiante, se présente sous la forme d'un solide incolore à l'odeur d'acide nitrique..
Ils ne sont pas combustibles, mais ils peuvent accélérer la combustion des matières combustibles. Si de grandes quantités de nitrate d'aluminium sont impliquées, ou si le matériau combustible est finement divisé, une explosion peut se produire..

Une exposition prolongée au feu ou à la chaleur peut provoquer une explosion. Lorsqu'ils entrent en contact avec le feu, ils produisent des oxydes d'azote. Ses utilisations comprennent le raffinage du pétrole, la teinture et le tannage du cuir..
C'est un sel blanc soluble dans l'eau qui se présente le plus souvent sous sa forme cristalline nonahydratée (nitrate d'aluminium nonahydraté)..
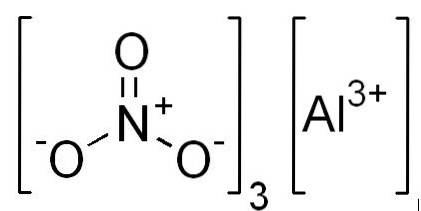
Index des articles
- 1 Formules
- 2 Structure
- 2.1 En 2D
- 2.2 En 3D
- 3 Propriétés physiques et chimiques
- 3.1 Alertes de réactivité
- 3.2 Réactions avec l'air et l'eau
- 3.3 Inflammabilité
- 3.4 Réactivité
- 3.5 Toxicité
- 4 utilisations
- 5 Effets cliniques
- 6 Sécurité et risques
- 6.1 Classes de danger du SGH
- 6.2 Codes des conseils de prudence
- 7 Références
Formules
- Nitrate d'aluminium: Al (NON3)3
- Nitrate d'aluminium nonahydraté: Al (NO3)3 9HdeuxOU ALORS
- CAS: 13473-90-0 Nitrate d'aluminium (anhydre)
- CAS: 14797-65-0 Nitrate d'aluminium (nonahydraté)
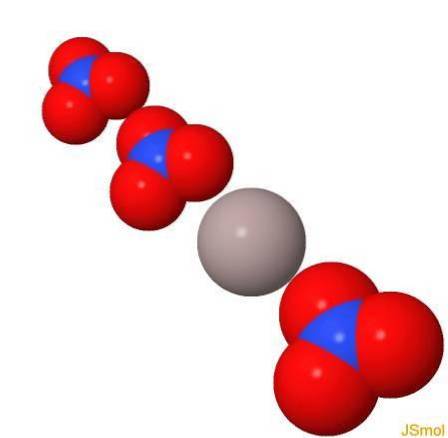
Structure
En 2D
En 3d
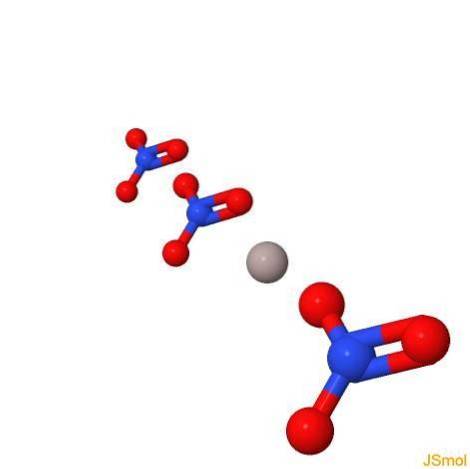
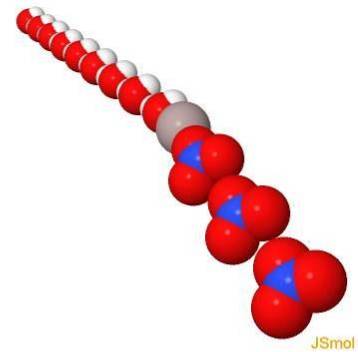
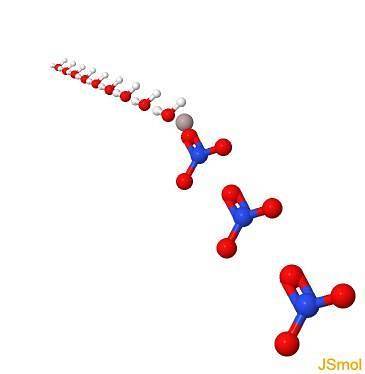
Proprietes physiques et chimiques
- Le nitrate d'aluminium appartient au groupe réactif des composés inorganiques de nitrate et de nitrite.
- L'ion nitrate est un ion polyatomique de formule moléculaire NO3 - et est la base conjuguée de l'acide nitrique.
- Presque tous les sels de nitrate inorganiques sont solubles dans l'eau à une température et une pression normales..
- Les composés nitrés ont une large gamme d'utilisations en fonction de leur activité en tant qu'agents oxydants, de la présence d'azote librement disponible ou de leur forte solubilité..
Alertes de réactivité
Le nitrate d'aluminium est un agent oxydant puissant.
Réactions avec l'air et l'eau
Le nitrate d'aluminium est déliquescent (il a la propriété d'absorber l'humidité de l'air pour former une solution aqueuse). Il est soluble dans l'eau. Ses solutions aqueuses sont acides.
Inflammabilité
Les nitrates et les nitrites sont des composés explosifs. Certaines de ces substances peuvent se décomposer de manière explosive lorsqu'elles sont chauffées ou impliquées dans un incendie. Ils peuvent exploser à cause de la chaleur ou de la contamination. Les contenants peuvent exploser lorsqu'ils sont chauffés.
Dangers particuliers dus aux produits de combustion: des oxydes d'azote toxiques peuvent se former lors d'un incendie impliquant du nitrate d'aluminium.
Réactivité
Les nitrates et les nitrites peuvent agir comme des agents oxydants extrêmement puissants et les mélanges avec des agents réducteurs ou des matériaux réduits tels que des substances organiques peuvent être explosifs. Réagit avec les acides pour former du dioxyde d'azote toxique.
En général, les sels de nitrate et de nitrite avec des cations actifs redox (métaux de transition et les métaux des groupes 3a, 4a et 5a du tableau périodique, ainsi que le cation ammonium [NH4] +) sont plus réactifs avec les matériaux et agents organiques. dans des conditions ambiantes.
Le nitrate d'aluminium est un agent oxydant. Les mélanges avec des esters d'alkyle peuvent exploser. Les mélanges avec du phosphore, du chlorure d'étain (II) ou d'autres agents réducteurs peuvent réagir de manière explosive.
Toxicité
Les humains sont sujets à la toxicité des nitrates et des nitrites, les enfants étant particulièrement vulnérables à la méthémoglobinémie.
L'ingestion de fortes doses de nitrate d'aluminium provoque une irritation gastrique, des nausées, des vomissements et de la diarrhée. Le contact avec la poussière irrite les yeux et la peau.
Applications
Les nitrates et les nitrites sont largement utilisés (et en très grande quantité) comme engrais en agriculture en raison de leur volonté de décomposer et de libérer de l'azote pour la croissance des plantes et en raison de leur solubilité, qui permet aux ions nitrate d'être absorbés par les racines de la plante..
Les composés de nitrate sont également largement utilisés comme matière première industrielle lorsqu'un agent oxydant ou une source d'ions nitrate est nécessaire..
Le nitrate d'aluminium est utilisé dans la fabrication de produits chimiques de laboratoire, cosmétiques et d'hygiène personnelle. Dans l'industrie, il est utilisé comme intermédiaire dans la fabrication d'autres substances.
Il est utilisé dans le tannage du cuir, dans les antisudorifiques, les inhibiteurs de corrosion, dans l'extraction de l'uranium, le raffinage du pétrole et comme agent nitrant..
Le nitrate d'aluminium nonahydraté et les autres nitrates d'aluminium hydratés ont de nombreuses applications. Ces sels sont utilisés pour produire de l'alumine pour la préparation de papiers isolants, dans les éléments chauffants des tubes cathodiques et dans les stratifiés de coeur des transformateurs. Les sels hydratés sont également utilisés pour l'extraction d'éléments actinidiques.
Effets cliniques
L'aluminium est omniprésent, c'est le métal le plus abondant de la croûte terrestre. La plupart des expositions humaines proviennent de la nourriture. Il est présent dans certains produits pharmaceutiques. Dans l'industrie, il est largement utilisé.
L'aluminium inhibe le remodelage osseux, provoquant une ostéomalacie. On pense qu'il inhibe l'érythropoïèse, provoquant une anémie.
Les intoxications aiguës sont rares. Les formes solubles d'aluminium ont un plus grand potentiel de toxicité que les formes insolubles, en raison de leur plus grande absorption..
Les patients souffrant d'insuffisance rénale sont sujets à la toxicité de l'aluminium, soit de l'aluminium dans le dialysat ou d'autres sources exogènes, en particulier les liants de phosphate et les antiacides contenant de l'aluminium..
Une exposition chronique à la poussière d'aluminium peut provoquer une dyspnée, une toux, une fibrose pulmonaire, un pneumothorax, une pneumoconiose, une encéphalopathie, une faiblesse, une incoordination et des crises d'épilepsie..
Les sels d'aluminium peuvent provoquer une irritation des yeux et des muqueuses, une conjonctivite, une dermatose et un eczéma..
Bien que l'aluminium et ses composés aient montré peu de preuves de cancérogénicité chez l'homme, l'exposition à d'autres substances impliquées dans la production d'aluminium a été associée à une cancérogénicité..
Sécurité et risques
Mentions de danger du Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH).
Le Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH) est un système internationalement reconnu, créé par les Nations Unies et conçu pour remplacer les diverses normes de classification et d'étiquetage utilisées dans différents pays en utilisant des critères cohérents à l'échelle mondiale..
Les classes de danger (et leur chapitre correspondant du SGH), les normes de classification et d'étiquetage, et les recommandations pour le nitrate d'aluminium et pour le nitrate d'aluminium nonahydraté sont les suivantes (Agence européenne des produits chimiques, 2017; Nations Unies, 2015; PubChem, 2017):
Classes de danger du SGH
H272: Peut aggraver un incendie; Comburant [Avertissement Liquides oxydants; Matières solides comburantes - Catégorie 3] (PubChem, 2017).
H301: Toxique en cas d'ingestion [Danger de toxicité aiguë, voie orale - Catégorie 3] (PubChem, 2017).
H315: Provoque une irritation cutanée [Avertissement Corrosion cutanée / irritation cutanée - Catégorie 2] (PubChem, 2017).
H318: Provoque des lésions oculaires graves [Danger Lésions oculaires graves / irritation oculaire - Catégorie 1] (PubChem, 2017).
H319: Provoque une sévère irritation des yeux [Attention Lésions oculaires graves / irritation oculaire - Catégorie 2A] (PubChem, 2017).
Codes des conseils de prudence
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 et P501 (PubChem, 2017).





Les références
- ChemIDplus (2017) Structure 3D de 13473-90-0 - Nitrate d'aluminium [image] Récupéré de: chem.nlm.nih.gov.
- ChemIDplus (2017) Structure 3D de 7784-27-2 - Nitrate d'aluminium nonahydraté [image] Récupéré de: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [image] Récupéré de: flickr.com.
- Edgar181 (2008) Nitrate d'aluminium [image]. Récupéré de: wikipedia.org.
- Agence européenne des produits chimiques (ECHA). (2016). Nitrate d'aluminium. Bref profil. Récupéré le 8 février 2017 sur echa.europa.eu.
- Banque de données sur les substances dangereuses (HSDB). TOXNET. (2017). Nitrate d'aluminium. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: chem.nlm.nih.gov.
- JSmol (2017) Nitrate [image] Récupéré de: chemapps.stolaf.edu.
- Wikipédia. (2017). Nitrate d'aluminium. Extrait le 8 février 2017 de: wikipedia.org.
- Wikipédia. (2017). Nitrate d'aluminium nonahydraté. Extrait le 8 février 2017 de: wikipedia.org.


Personne n'a encore commenté ce post.