
Structure, propriétés, utilisations, risques du nitrobenzène (C6H5NO2)
le nitrobenzène est un composé organique aromatique formé par un cycle benzénique C6H5- et un groupe nitro -NOdeux. Sa formule chimique est C6H5NE PASdeux. C'est un liquide huileux incolore ou jaune pâle, à l'odeur d'amande amère ou de cirage à chaussures..
Le nitrobenzène est un composé très utile dans l'industrie chimique car il permet d'obtenir une série de substances chimiques qui ont des utilisations diverses. En effet, il peut être soumis à différents types de réactions.
Les réactions chimiques importantes incluent la nitration (qui permet d'ajouter plus de groupes -NOdeux à la molécule) et la réduction (le contraire de l'oxydation puisque les deux atomes d'oxygène du groupement nitro -NO sont éliminésdeux et sont remplacés par des hydrogènes).
Avec du nitrobenzène, par exemple, l'aniline et le para-acétaminophénol peuvent être préparés. Ce dernier est l'acétaminophène bien connu qui est un antipyrétique (médicament contre la fièvre) et un analgésique léger (médicament contre la douleur mineure)..
Le nitrobenzène doit être manipulé avec précaution car il est irritant et toxique, il peut provoquer un type d'anémie, parmi plusieurs symptômes, et on pense qu'il provoque le cancer. Il est également nocif pour l'environnement.
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Point d'éclair
- 3.6 Température d'auto-inflammation
- 3.7 Densité
- 3.8 Solubilité
- 3.9 Propriétés chimiques
- 3.10 Formation de dimères
- 3.11 Autres propriétés
- 4 Obtention
- 5 utilisations
- 5.1 Pour obtenir de l'aniline et de l'acétaminophène
- 5.2 Pour obtenir d'autres composés chimiques
- 5.3 Dans diverses applications
- 6 risques
- 7 Traitements pour son élimination de l'environnement
- 8 Références
Structure
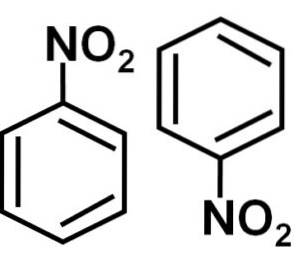
Nitrobenzène C6H5-NE PASdeux est une molécule plate formée par un cycle benzénique C6H5- auquel un groupe nitro -NO est attachédeux. Sa molécule est plate car il y a une interaction électronique entre le groupe nitro -NOdeux et le cycle benzénique.
Le groupe nitro -NOdeux a tendance à attirer les électrons du cycle benzénique C6H5-.
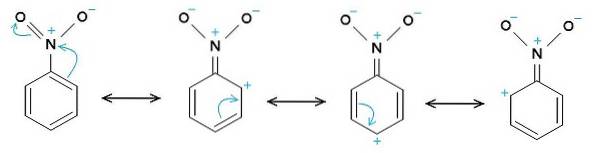
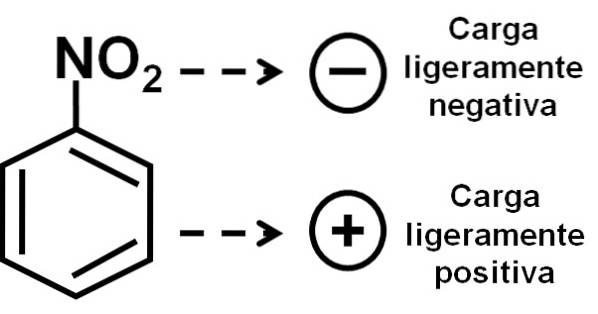
Par conséquent, la molécule a un côté légèrement plus négatif (où les oxygènes de -NOdeux) et un côté légèrement plus positif (le cycle benzénique).
Nomenclature
- Nitrobenzène.
- Nitrobenzine.
- Nitrobenzole.
- Huile ou essence myrban ou myrban (terme désaffecté).
Propriétés
État physique
Liquide huileux incolore à jaune pâle.
Poids moléculaire
123,11 g / mol.
Point de fusion
5,7 ºC.
Point d'ébullition
211 ºC.
Point d'inflammation
88 ºC (méthode en coupe fermée).
La température d'auto-inflammation
480 ° C.
Densité
1,2037 g / cm3 à 20 ºC.
Solubilité
Légèrement soluble dans l'eau: 0,19 g / 100 g d'eau à 20 ° C. Entièrement miscible avec l'alcool, le benzène et l'éther diéthylique.
Propriétés chimiques
Le nitrobenzène est stable jusqu'à une température d'environ 450 ° C à laquelle il commence à se décomposer formant (en l'absence d'oxygène) NO, NOdeux, benzène, biphényle, aniline, dibenzofurane et naphtalène.
Les réactions importantes du nitrobenzène comprennent la réduction, la nitration, l'halogénation et la sulfonation..
La nitration du nitrobenzène produit initialement du métha-nitrobenzène et avec un temps de réaction prolongé on obtient du 1,3,5-nitrobenzène.
En faisant réagir du brome ou du chlore avec du nitrobenzène en présence d'un catalyseur approprié, on obtient du 3-bromo-nitrobenzène (méta-bromonitrobenzène) ou du 3-chloro-nitrobenzène (méta-chloronitrobenzène)..
Un exemple de réduction est que lors du traitement avec de l'étain (Sn) dans l'acide chlorhydrique (HCl), les méta-halogénonitrobenzènes sont obtenus les méta-halogénoanilines.
La nitrobenzène sulfonation est effectuée avec de l'acide sulfurique fumant à 70-80 ° C et le produit est l'acide méta-nitrobenzènesulfonique. Cela peut être réduit avec du fer et du HCl pour donner de l'acide méthanilique..
Formation de dimère
Dans une solution de benzène C6H6 les molécules de nitrobenzène s'associent les unes aux autres pour former des dimères ou des paires de molécules. Dans ces couples, l'une des molécules est en position inversée par rapport à l'autre..
La formation de dimères de nitrobenzène avec des molécules l'une en position inversée par rapport à l'autre est peut-être due au fait que chacun d'eux a un côté légèrement plus chargé positivement et un côté opposé avec une charge légèrement plus négative..
Dans le dimère, le côté avec une charge légèrement plus positive de l'une des molécules est éventuellement situé à proximité de la charge légèrement négative de l'autre molécule, puisque les charges opposées s'attirent, et c'est le cas des deux autres côtés..
Autres propriétés
A une odeur similaire à celle des amandes ou du cirage à chaussures. En abaissant sa température, il se solidifie sous la forme de cristaux jaune verdâtre.
Obtention
Obtenu en traitant le benzène C6H6 avec un mélange d'acide nitrique HNO3 et acide sulfurique HdeuxSW4. Le processus s'appelle la nitration et implique la formation de l'ion nitronium NOdeux+ grâce à la présence d'acide sulfurique HdeuxSW4.
- Formation de NO d'ion nitroniumdeux+:
HNO3 + 2 heuresdeuxSW4 ⇔ H3OU ALORS+ + 2 HSO4- + NE PASdeux+ (ion nitronium)
- L'ion nitronium attaque le benzène:
C6H6 + NE PASdeux+ → C6H6NE PASdeux+
- Le nitrobenzène se forme:
C6H6NE PASdeux+ + HSO4- → C6H5NE PASdeux + HdeuxSW4
En résumé:
C6H6 + HNO3 → C6H5NE PASdeux + HdeuxOU ALORS
La réaction de nitration du benzène est très exothermique, c'est-à-dire que beaucoup de chaleur est générée, donc c'est très dangereux.
Applications
Pour obtenir de l'aniline et de l'acétaminophène
Le nitrobenzène est principalement utilisé pour synthétiser l'aniline C6H5NHdeux, qui est un composé largement utilisé pour la préparation de pesticides, de gommes, de colorants, d'explosifs et de médicaments.
L'obtention de l'aniline se fait par réduction du nitrobenzène en milieu acide en présence de fer ou d'étain, qui s'effectue selon les étapes suivantes:
Nitrobenzène → Nitrosobenzène → Phénylhydroxylamine → Aniline
C6H5NE PASdeux → C6H5NON → C6H5NHOH → C6H5NHdeux

Selon les conditions, le procédé peut être arrêté dans l'une des étapes intermédiaires par exemple la phénylhydroxylamine. A partir de phénylhydroxylamine en milieu fortement acide, le para-aminophénol peut être préparé:
Phénylhydroxylamine → p-Aminophénol
C6H5NHOH → HOC6H4NHdeux
Ce dernier est traité avec de l'anhydride acétique pour obtenir du paracétamol (acétaminophène), un antipyrétique et analgésique doux connu, c'est-à-dire un médicament pour traiter la fièvre et la douleur..
Une autre manière d'obtenir de l'aniline consiste à réduire le nitrobenzène avec du monoxyde de carbone (CO) en milieu aqueux en présence de très petites particules (nanoparticules) de palladium (Pd) comme catalyseur..
C6H5-NE PASdeux + 3 CO + HdeuxO → C6H5-NHdeux + 3 COdeux
Pour obtenir d'autres composés chimiques
Le nitrobenzène est le point de départ pour obtenir une grande variété de composés utilisés comme colorants, pesticides, médicaments et cosmétiques.

Par exemple, il permet d'obtenir du 1,3-dinitrobenzène qui, par chloration (ajout de chlore) et réduction (élimination des atomes d'oxygène), génère de la 3-chloroaniline. Ceci est utilisé comme intermédiaire pour les pesticides, les colorants et les médicaments.
Le nitrobenzène a été utilisé pour préparer la benzidine qui est un colorant. De plus, le nitrobenzène est utilisé pour préparer la quinoléine, l'azobenzène, l'acide méthanilique, le dinitrobenzène, les isocyanates ou la pyroxyline parmi de nombreux autres composés..
Dans diverses applications
Le nitrobenzène est utilisé ou a été utilisé comme:
- Solvant d'extraction pour la purification des huiles lubrifiantes utilisées dans les machines
- Solvant pour éthers de cellulose
- Ingrédient de mélange de polissage des métaux
- Dans les savons
- Dans les mélanges de cirage de chaussures
- Conservateur de peinture en aérosol
- Composant de mélanges de polissage de sol
- Substitut d'essence d'amande
- Dans l'industrie du parfum
- Dans la production de caoutchouc synthétique
- Solvant dans divers processus

Des risques
Le nitrobenzène est toxique par inhalation, ingestion et absorption par la peau..
Irritant pour la peau, les yeux et les voies respiratoires. Elle peut provoquer un type d'anémie appelé méthémoglobinémie, qui entraîne une réduction de la capacité des globules rouges à libérer de l'oxygène dans les tissus et conduit à la fatigue..
De plus, le nitrobenzène provoque une dyspnée, des étourdissements, une altération de la vision, un essoufflement, un collapsus et la mort. Il endommage également le foie, la rate, les reins et le système nerveux central.
On estime qu'il peut être un mutagène et possiblement une cause de cancer chez l'homme, car il l'a causé chez les animaux.
De plus, le nitrobenzène ne doit pas être jeté dans l'environnement. Sa toxicité envers les animaux, les plantes et les microorganismes le rend très nocif pour les écosystèmes.
La toxicité envers les microorganismes réduit leur biodégradabilité.
Traitements pour son élimination de l'environnement
La contamination de l'environnement par le nitrobenzène peut se produire par les déchets des diverses industries qui l'utilisent, telles que l'industrie des colorants ou des explosifs..
Le nitrobenzène est un polluant hautement toxique et difficile à décomposer dans des conditions naturelles, c'est pourquoi il peut provoquer une grave contamination de l'eau potable et des systèmes d'irrigation des cultures..
En raison de sa grande stabilité et de sa toxicité envers les microorganismes, il est souvent choisi comme modèle dans les études de traitement des eaux usées..
Divers moyens d'éliminer le nitrobenzène de l'eau contaminée sont à l'étude. L'un d'eux est par dégradation photocatalytique, c'est-à-dire en utilisant la lumière du soleil comme accélérateur de la réaction de dégradation en présence de dioxyde de titane TiOdeux.

Les méthodes de microélectrolyse avec un catalyseur au fer (Fe) et au cuivre (Cu) en céramique ont également été testées avec succès. La microélectrolyse permet au nitrobenzène d'être décomposé par un courant électrique.
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Nitrobenzène. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Morrison et R.T. et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.
- Moldoveanu, S.C. (2019). Pyrolyse d'autres composés contenant de l'azote. In Pyrolyse of Organic Molecules (deuxième édition). Récupéré de sciencedirect.com.
- Smith, P.W.G. et coll. (1969). Composés aromatiques de nitration-nitro. Substitutions électrophiles. En chimie aromatique. Récupéré de sciencedirect.com.
- Windholz, M. et coll. (éditeurs) (1983). L'indice Merck. Une encyclopédie des produits chimiques, des médicaments et des produits biologiques. Dixième édition. Merck & CO., Inc.
- Encyclopédie Ullmann de chimie industrielle. (1990). Cinquième édition. Volume A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et coll. (2012). Dégradation photocatalytique irradiée aux UV du nitrobenzène par liaison au titane sur tube de quartz. International Journal of Photoenergy, Volume 2012, Article ID 681941. Récupéré de hindawi.com.
- Shikata, T. et coll. (2014). Formation de dimères anti-parallèles de nitrobenzène dans des solvants non polaires. AIP Advances 4, 067130 (2014). Récupéré de doaj.org.
- Krogul-Sobczak, A. et coll. (2019). Réduction du nitrobenzène en aniline par CO / HdeuxO en présence de nanoparticules de palladium. Catalysts 2019, 9, 404. Récupéré de mdpi.com.
- Yang, B. et coll. (2019). Production à l'échelle pilote, propriétés et application de la charge céramique-catalytique Fe / Cu pour le traitement des eaux usées des composés de nitrobenzène. Catalysts 2019, 9, 11. Récupéré de mdpi.com.



Personne n'a encore commenté ce post.