
Structure, fonctions et exemples des nucléoprotéines
Ongle nucléoprotéine Il s'agit de tout type de protéine structurellement associé à un acide nucléique - soit ARN (acide ribonucléique), soit ADN (acide désoxyribonucléique). Les exemples les plus marquants sont les ribosomes, les nucléosomes et les nucléocapsides dans les virus..
Cependant, toute protéine qui se lie à l'ADN ne peut pas être considérée comme une nucléoprotéine. Celles-ci se caractérisent par la formation de complexes stables et non par une simple association transitoire - comme les protéines qui interviennent dans la synthèse et la dégradation de l'ADN, qui interagissent momentanément et brièvement..
Les fonctions des nucléoprotéines varient largement et dépendent du groupe à étudier. Par exemple, la fonction principale des histones est le compactage de l'ADN en nucléosomes, tandis que les ribosomes participent à la synthèse des protéines..
Index des articles
- 1 Structure
- 2 Nature de l'interaction
- 3 Classification et fonctions
- 3.1 Désoxyribonucléoprotéines
- 3.2 Ribonucléoprotéines
- 4 exemples
- 4.1 Histones
- 4.2 Protamines
- 4.3 Ribosomes
- 5 Références
Structure
Généralement, les nucléoprotéines sont constituées d'un pourcentage élevé de résidus d'acides aminés basiques (lysine, arginine et histidine). Chaque nucléoprotéine a sa propre structure particulière, mais toutes convergent pour contenir des acides aminés de ce type.
Au pH physiologique, ces acides aminés sont chargés positivement, ce qui favorise les interactions avec les molécules du matériel génétique. Ensuite, nous verrons comment ces interactions se produisent.
Nature de l'interaction
Les acides nucléiques sont constitués d'un squelette de sucres et de phosphates, qui leur confèrent une charge négative. Ce facteur est essentiel pour comprendre comment les nucléoprotéines interagissent avec les acides nucléiques. La liaison qui existe entre les protéines et le matériel génétique est stabilisée par des liaisons non covalentes.
De même, en suivant les principes de base de l'électrostatique (loi de Coulomb), nous constatons que des charges de signes différents (+ et -) attirent.
L'attraction entre les charges positives et négatives des protéines et du matériel génétique donne lieu à des interactions non spécifiques. En revanche, des jonctions spécifiques se produisent dans des séquences spécifiques, telles que l'ARN ribosomal..
Il existe différents facteurs susceptibles de modifier les interactions entre la protéine et le matériel génétique. Parmi les plus importantes figurent les concentrations de sels, qui augmentent la force ionique de la solution; tensioactifs ionogènes et autres composés chimiques de nature polaire, tels que le phénol, le formamide, entre autres.
Classification et fonctions
Les nucléoprotéines sont classées en fonction de l'acide nucléique auquel elles sont attachées. Ainsi, on peut distinguer deux groupes bien définis: les désoxyribonucléoprotéines et les ribonucléoprotéines. Logiquement, le premier ADN cible, et le dernier ARN.
Désoxyribonucléoprotéines
La fonction la plus importante des désoxyribonucléoprotéines est le compactage de l'ADN. La cellule fait face à un défi qui semble presque impossible à surmonter: enrouler correctement près de deux mètres d'ADN dans un noyau microscopique. Ce phénomène peut être atteint grâce à l'existence de nucléoprotéines qui organisent le brin.
Ce groupe est également associé à des fonctions de régulation dans les processus de réplication, de transcription d'ADN, de recombinaison homologue, entre autres..
Ribonucléoprotéines
Les ribonucléoprotéines, quant à elles, remplissent des fonctions essentielles, qui vont de la réplication de l'ADN à la régulation de l'expression génique et à la régulation du métabolisme central de l'ARN..
Ils sont également liés à des fonctions protectrices, car l'ARN messager n'est jamais libre dans la cellule, car il est sujet à la dégradation. Pour éviter cela, une série de ribonucléoprotéines s'associe à cette molécule dans des complexes protecteurs..
Le même système se retrouve dans les virus, qui protègent leurs molécules d'ARN de l'action d'enzymes qui pourraient le dégrader.
Exemples
Histones
Les histones correspondent au composant protéique de la chromatine. Ils sont les plus importants dans cette catégorie, bien que nous trouvions également d'autres protéines liées à l'ADN qui ne sont pas des histones, et sont incluses dans un grand groupe appelé protéines non histoniques..
Structurellement, ce sont les protéines les plus basiques de la chromatine. Et, du point de vue de l'abondance, ils sont proportionnels à la quantité d'ADN.
Nous avons cinq types d'histones. Sa classification était basée, historiquement, sur la teneur en acides aminés basiques. Les classes d'histones sont pratiquement invariables parmi les groupes eucaryotes.
Cette conservation évolutive est attribuée au rôle énorme que jouent les histones dans les êtres organiques.
Si la séquence qui code pour une histone change, l'organisme fera face à de graves conséquences, car son emballage d'ADN sera défectueux. Ainsi, la sélection naturelle est responsable de l'élimination de ces variantes non fonctionnelles.
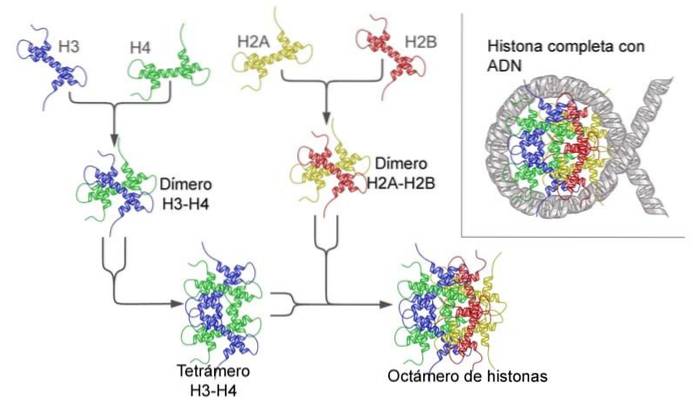
Parmi les différents groupes, les plus conservés sont les histones H3 et H4. En fait, les séquences sont identiques chez des organismes aussi éloignés - phylogénétiquement parlant - qu'une vache et un pois..
L'ADN s'enroule dans ce qu'on appelle l'octamère d'histone, et cette structure est le nucléosome - le premier niveau de compactage du matériel génétique..
Protamines
Les protamines sont de petites protéines nucléaires (chez les mammifères, elles sont composées d'un polypeptide de près de 50 acides aminés), caractérisées par une teneur élevée en résidu d'acide aminé arginine. Le rôle principal des protamines est de remplacer les histones dans la phase haploïde de la spermatogenèse.
Il a été proposé que ces types de protéines basiques soient cruciaux pour l'encapsidation et la stabilisation de l'ADN dans le gamète mâle. Ils diffèrent des histones en ce qu'ils permettent un emballage plus dense.
Chez les vertébrés, de 1 à 15 séquences codant pour des protéines ont été trouvées, toutes regroupées sur le même chromosome. La comparaison des séquences suggère qu'ils ont évolué à partir d'histones. Les plus étudiés chez les mammifères sont appelés P1 et P2.
Ribosomes
L'exemple le plus frappant de protéines qui se lient à l'ARN est celui des ribosomes. Ce sont des structures présentes dans pratiquement tous les êtres vivants - des petites bactéries aux grands mammifères.
Les ribosomes ont pour fonction principale de traduire le message d'ARN en une séquence d'acides aminés.
Il s'agit d'une machinerie moléculaire très complexe, composée d'un ou plusieurs ARN ribosomaux et d'un ensemble de protéines. On peut les trouver libres dans le cytoplasme cellulaire, ou ancrés dans le réticulum endoplasmique rugueux (en fait, l'aspect «rugueux» de ce compartiment est dû aux ribosomes).
Il existe des différences de taille et de structure des ribosomes entre les organismes eucaryotes et procaryotes..
Les références
- Baker, T. A., Watson, J. D., Bell, S. P., Gann, A., Losick, M. A. et Levine, R. (2003). Biologie moléculaire du gène. Société d'édition Benjamin-Cummings.
- Balhorn, R. (2007). La famille des protamines des protéines nucléaires du sperme. Biologie du génome, 8(9), 227.
- Darnell, J. E., Lodish, H. F., et Baltimore, D. (1990). Biologie cellulaire moléculaire. Livres scientifiques américains.
- Jiménez García, L. F. (2003). Biologie cellulaire et moléculaire. Pearson Education of Mexico.
- Lewin, B (2004). Gènes VIII. Salle des Prentices Pearson.
- Teijón, J. M. (2006). Fondamentaux de la biochimie structurale. Éditorial Tébar.



Personne n'a encore commenté ce post.