
Structure du peroxyde de sodium (Na2O2), propriétés, utilisations

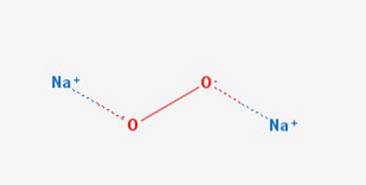
le peroxyde de sodium est un composé chimique de formule NadeuxOU ALORSdeux Il a deux liaisons ioniques entre les deux atomes de sodium et la molécule d'O2. Il existe dans divers hydrates et peroxyhydrates dont NadeuxOU ALORSdeux 2HdeuxOU ALORSdeux 4HdeuxSur undeuxOU ALORSdeux 2HdeuxSur undeuxOU ALORSdeux 2HdeuxOU ALORSdeux et NadeuxOU ALORSdeux 8HdeuxOU ALORS.
Elle a une structure cristalline hexagonale, cependant, lorsqu'elle est chauffée, cette forme subit une transition vers une phase de symétrie inconnue à 512 ° C. Sa structure cristalline est représentée sur la figure 2 (Sodium: peroxyde de sodium, 1993-2016).

Le peroxyde de sodium peut être préparé à grande échelle en faisant réagir du sodium métallique avec de l'oxygène à 130-200 ° C (Ashford, 1994), un processus qui génère de l'oxyde de sodium, qui dans une étape séparée absorbe l'oxygène:
4 Na + Odeux → NadeuxOU ALORS
2 NadeuxO + Odeux → 2 NadeuxOU ALORSdeux
Le présent procédé discontinu implique l'oxydation du sodium dans du monoxyde de sodium avec de l'air sec et l'oxydation ultérieure du monoxyde dans du peroxyde avec 90% d'oxygène..
En 1951, USI a commencé à exploiter le premier procédé continu de production de peroxyde de sodium. Le processus est unique sur un point: il utilise de l'air au lieu de l'oxygène pur.
Des variations d'un procédé par lots sont utilisées depuis près de 70 ans (SCHOW, 1957), par exemple, le produit commercial contient entre 90 et 95% de peroxyde d'hydrogène.
Index des articles
- 1 Propriétés physiques et chimiques du peroxyde de sodium
- 2 Réactivité et dangers
- 3 utilisations
- 4 Références
Propriétés physiques et chimiques du peroxyde de sodium
Le peroxyde de sodium est un solide granulaire jaunâtre qui vire au jaune au contact de l'atmosphère (National Center for Biotechnology Information, S.F.). Leur apparence est illustrée à la figure 3.

Le peroxyde de sodium a un poids moléculaire de 77,98 g / mol et une densité de 2,805 g / ml. Le composé a un point de fusion de 460,00 ° C où il commence à se décomposer en oxyde de sodium et en oxygène moléculaire selon la réaction:
2 Na2O2 → 2 Na2O + O2
Son point d'ébullition est de 657 ° C (Royal Society of Chemistry, 2015).
Le peroxyde de sodium réagit violemment avec les agents réducteurs, les matières combustibles et les métaux légers. Réagit de manière exothermique et rapide ou même explosive avec l'eau pour former une base forte (NaOH) et de l'oxygène (O2).
Un mélange avec du persulfate d'ammonium peut exploser s'il est soumis à un frottement (broyage dans un mortier), s'il est chauffé ou si un courant de gaz carbonique est passé dessus..
Réagit très vigoureusement avec le sulfure d'hydrogène gazeux. Même en l'absence d'air, la réaction peut être accompagnée d'une flamme. Une explosion se produit lorsque du gaz carbonique passe sur un mélange de peroxyde de sodium et de poudre de magnésium..
Les mélanges avec de l'acide acétique ou de l'anhydride acétique peuvent exploser s'ils ne sont pas conservés au froid. Ils sont spontanément inflammables au contact de l'aniline, du benzène, de l'éther diéthylique ou de matériaux organiques tels que le papier et le bois..
Les mélanges avec du charbon de bois, de la glycérine, certaines huiles et du phosphore brûlent ou explosent. Un mélange avec du carbure de calcium (poudre) peut s'enflammer lorsqu'il est exposé à l'air humide et exploser lorsqu'il est chauffé.
Il se décompose, souvent violemment en présence de quantités catalytiques de dioxyde de manganèse. Le mélange avec du monochlorure de soufre conduit à une violente réaction. Il peut réagir et provoquer l'inflammation des carburants (PEROXYDE DE SODIUM, 2016).
Réactivité et dangers
Le peroxyde de sodium est un composé classé comme base forte, explosif et oxydant fort en fonction de son alerte de réactivité. Les mélanges avec des matériaux combustibles s'enflamment facilement par frottement, chaleur ou contact avec l'humidité.
Peut se décomposer vigoureusement en cas d'exposition prolongée à la chaleur, provoquant la rupture des récipients qui le contiennent.
Très dangereux en cas de contact avec la peau et les yeux (irritant) et en cas d'ingestion et d'inhalation. Une exposition prolongée peut provoquer des brûlures et des ulcérations cutanées. Une surexposition par inhalation peut provoquer une irritation respiratoire..
L'inflammation de l'œil se caractérise par une rougeur, un larmoiement et des démangeaisons. L'inflammation de la peau est caractérisée par des démangeaisons, une desquamation, des rougeurs ou parfois des cloques.
En cas de contact visuel, vous devez vérifier si vous portez des lentilles de contact et les retirer. Les yeux doivent être rincés immédiatement à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes..
En cas de contact avec la peau, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif. De l'eau froide peut être utilisée. La peau irritée doit être recouverte d'un émollient.
Si le contact avec la peau est sévère, elle doit être lavée avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne..
En cas d'inhalation, la victime doit être autorisée à se reposer dans un endroit bien ventilé..
Évacuez la victime vers une zone sûre dès que possible. Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la respiration est difficile, donnez de l'oxygène. Si la victime ne respire pas, effectuez une réanimation bouche-à-bouche.
En cas d'ingestion, les vomissements ne doivent pas être provoqués. Si la victime ne respire pas, effectuez une réanimation bouche-à-bouche.
Dans tous les cas, consulter immédiatement un médecin (Fiche de données de sécurité Peroxyde de sodium, 2013).
Applications
Le peroxyde de sodium est utilisé dans les décolorants pour vêtements, car il réagit avec l'eau pour produire du peroxyde d'hydrogène, un agent de blanchiment selon la réaction:
N / AdeuxOU ALORSdeux + 2 heuresdeuxO → 2 NaOH + HdeuxOU ALORSdeux
En plus du peroxyde d'hydrogène, la réaction produit de l'hydroxyde de sodium (lessive), qui maintient la solution alcaline. De l'eau chaude et une solution alcaline sont toutes deux nécessaires pour que le peroxyde d'hydrogène fonctionne le mieux comme agent de blanchiment (Field, S.F.).
Le peroxyde de sodium est utilisé pour blanchir la pâte de bois pour la production de papier et de textiles. Il est actuellement principalement utilisé pour des opérations de laboratoire spécialisées, par exemple l'extraction de minéraux. De plus, le peroxyde de sodium est utilisé comme agent oxydant dans les réactions chimiques..
Il est également utilisé comme source d'oxygène en le faisant réagir avec du dioxyde de carbone pour produire de l'oxygène et du carbonate de sodium.Il est donc particulièrement utile dans les équipements de plongée, les sous-marins, etc. (Utilisation du peroxyde de sodium pour épurer les émissions de dioxyde de carbone, 2014).
Les références
- Ashford, R. (1994). Dictionnaire Ashford des produits chimiques industriels. Londres: Publications Ltd.
- Field, S. (S.F.). Ingrédients -Peroxyde de sodium. Récupéré de sci-toys.com.
- Fiche signalétique Peroxyde de sodium. (2013, 21 mai). Récupéré de sciencelab.com.
- Centre national d'information sur la biotechnologie. (S.F.). Base de données des composés PubChem; CID = 14803. Récupéré de PubChem.
- Société royale de chimie. (2015). Peroxyde de sodium. Récupéré de chemspider.com.
- SCHOW, H. R. (1957). L'histoire de la production de peroxyde de sodium. Advances in Chemistry, vol. 19, 118-123.
- PEROXYDE DE SODIUM. (2016). Récupéré de caméochimiques.
- Sodium: peroxyde de sodium. (1993-2016). Récupéré de Webelements.
- Utilisation de peroxyde de sodium pour épurer les émissions de dioxyde de carbone. (2014, 10 novembre). Récupéré de stackexchange.



Personne n'a encore commenté ce post.