
Structure, formule, propriétés, risques de l'oxyde de sodium (Na2O)

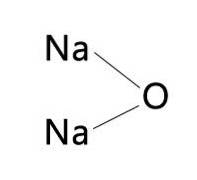
le oxyde de sodium est un composé inorganique de formule NadeuxO. Comme tous les oxydes de métaux alcalins, il a une structure cristalline similaire à l'antifluorite (similaire à la fluorite, CaF2, mais avec des cations et des anions inversés) correspondant à un cubique à faces centrées. (Sodium: oxyde disodique, 1993-2016).
On pourrait dire que l'oxyde de sodium est l'anhydride de l'hydroxyde de sodium, car il réagit avec l'eau pour former deux moles de ce composé de la manière suivante:
N / AdeuxO + HdeuxO → 2NaOH
Généralement, le nom KNaO peut être trouvé écrit, se référant à l'oxyde de sodium ou à l'oxyde de potassium. En effet, les deux oxydes ont des propriétés similaires en termes de couleur et de taux d'expansion et de contraction..
Les sources insolubles d'oxyde de sodium comprennent souvent des traces d'oxyde de potassium, par exemple dans les feldspaths (figure 2), qui sont la principale source de sodium dans certains émaux (Britt, 2007).

Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 3 utilisations
- 4 Références
Proprietes physiques et chimiques
L'oxyde de sodium est un solide cristallin blanc (figure 3). Il a un poids moléculaire de 61,98 g / mol, une densité de 2,27 g / ml et un point de fusion de 1275 ° C..
Le composé a un point d'ébullition de 1950 ° C où il commence à se décomposer en peroxyde de sodium et en sodium métallique, cependant, une propriété intéressante est que l'oxyde de sodium commence à se sublimer à 1100 ° C (National Center for Biotechnology Information, SF).

Réagit violemment avec l'eau et l'alcool pour former de l'hydroxyde de sodium. Oxyde de sodium, NadeuxOu, il absorbe de manière réversible l'hydrogène (Hdeux), pour former de l'hydrure de sodium (NaH) et de l'hydroxyde de sodium (NaOH), qui a le potentiel de trouver son application au stockage réversible de l'hydrogène.
Réactivité et dangers
L'oxyde de sodium est un composé stable ininflammable, mais il peut réagir violemment avec les acides et l'eau. Cela peut également augmenter la combustion d'autres substances. Il est classé comme corrosif et peut brûler la peau et les yeux (Royal Society of Chemistry, 2015).
La solution dans l'eau est une base forte, car elle réagit violemment avec les acides corrosifs. Réagir violemment avec l'eau produit de l'hydroxyde de sodium, attaquant de nombreux métaux en présence d'eau.
La substance est également corrosive pour les voies respiratoires et en cas d'ingestion. L'inhalation d'aérosol peut provoquer un œdème pulmonaire (National Institute for Occupational Safety and Health, 2014).
En cas d'inhalation, la personne affectée doit être déplacée dans un endroit frais. Si la victime ne respire pas, la respiration artificielle doit être pratiquée. Plus tard, allez ou consultez un médecin dès que possible.
En cas de contact avec la peau, les vêtements et chaussures contaminés doivent être enlevés immédiatement et lavés à grande eau..
En cas de contact avec les yeux, rincer abondamment à l'eau pendant au moins 15 minutes et consulter un médecin. En cas d'ingestion, ne pas faire vomir, mais rincer la bouche avec de l'eau et consulter un médecin..
Les symptômes et effets les plus importants peuvent être: spasmes, inflammation et œdème du larynx et des bronches, pneumonie, œdème pulmonaire, sensation de brûlure, toux, respiration sifflante, laryngite et difficulté à respirer (Oxyde de sodium (Na2O) (CAS 1313-59-3 ) Fiche signalétique, 2010-2017).
Les symptômes d'œdème pulmonaire n'apparaissent souvent pas pendant quelques heures et sont aggravés par l'effort physique. Le repos et l'observation médicale sont donc essentiels.
L'oxyde de sodium doit être stocké dans un endroit sec et séparé des acides forts. Étant donné que le composé réagit violemment avec l'eau, en cas d'incendie, les extincteurs à base d'eau ou les gicleurs ne doivent pas être utilisés. Il est recommandé d'utiliser de la poudre sèche ou du sable.
Applications
L'oxyde de sodium est principalement utilisé dans la fabrication du verre. Il est utilisé dans la céramique et les verres, mais pas sous forme brute. L'oxyde de sodium représente généralement environ 15% de la composition chimique du verre.
Il réduit la température de fusion du dioxyde de silicium (composition de verre à 70%), ce qui fait qu'il est moins coûteux et plus efficace de produire du verre, car il nécessite moins de dépenses énergétiques de la part du fabricant (George Sumner, nd).
Le verre sodocalcique est la forme de verre la plus couramment produite, comprenant environ 70% de silice (dioxyde de silicium), 15% de soude (oxyde de sodium) et 9% de chaux (oxyde de calcium), avec des quantités beaucoup plus élevées..
L'oxyde de sodium sert de fondant pour abaisser la température à laquelle la silice fond, et la chaux agit comme un stabilisant pour la silice. Le verre sodocalcique est bon marché, chimiquement stable, raisonnablement dur et extrêmement travaillable, car il peut être ramolli plusieurs fois si nécessaire..
Ces qualités le rendent adapté à la fabrication d'une large gamme de produits en verre, y compris les ampoules, verres, bouteilles et objets d'art..
D'autre part, l'oxyde de sodium et la silice contiennent du cristal d'eau, également appelé silicate de sodium ou verre d'eau, qui forme un solide vitreux avec la propriété très utile d'être soluble dans l'eau..
Le verre d'eau est vendu sous forme de grumeaux ou de poudres solides, ou sous forme de liquide clair et sirupeux. Il est utilisé comme source pratique de sodium pour de nombreux produits industriels tels que: un adjuvant dans les détergents à lessive, comme liant et adhésif, comme floculant dans les usines de traitement des eaux et dans de nombreuses autres applications (Enciclopaedia britannica, 2017).
Les composés oxydés ne conduisent pas l'électricité. Cependant, certains oxydes structurés de pérovskite sont des conducteurs électroniques destinés à être appliqués dans la cathode des piles à combustible à oxyde solide et des systèmes de génération d'oxygène (American Elements, 1998-2017)..
Les références
- Institut national pour la sécurité et la santé au travail. (2014, 1 juillet). OXYDE DE SODIUM CDC. Récupéré de cdc.
- Éléments américains. (1998-2017). Oxyde de sodium. Récupéré de americanelements.com.
- Britt, J. (2007). Le guide complet des glaçures à feu élevé. New York: Livres Lark.
- Encyclopédie Britannica. (2017). Composé chimique d'oxyde de sodium. Récupéré de britannica.com.
- George Sumner, D. J. (s.f.). Quelles sont certaines des utilisations de l'oxyde de sodium? Récupéré de quora.com.
- Centre national d'information sur la biotechnologie. (S.F.). Base de données des composés PubChem; CID = 73971. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Société royale de chimie. (2015). Oxyde de sodium. Récupéré de chemspider.com.
- Ruitao Wang, T. K. (2006). Réaction de l'hydrogène avec l'oxyde de sodium: Un système d'hydrogénation / déshydrogénation réversible. Journal of Power Sources, Volume 155, Numéro 2, 167-171. sciencedirect.com.
- Oxyde de sodium (Na2O) (CAS 1313-59-3) MSDS. (2010-2017). Récupéré de guidechem: guidechem.com.
- Sodium: oxyde disodique. (1993-2016). Récupéré de webelements: webelements.com.


Personne n'a encore commenté ce post.