
Histoire, structure, propriétés et utilisations du chlorure de polyvinyle

le chlorure de polyvinyle C'est un polymère dont l'utilisation industrielle a commencé à se développer au début du 20ème siècle, en raison entre autres de son faible coût, de sa durabilité, de sa résistance et de sa capacité d'isolation thermique et électrique, entre autres raisons. Cela lui a permis de déplacer les métaux dans de nombreuses applications et utilisations..
Comme son nom l'indique, il consiste en la répétition de nombreux monomères de chlorure de vinyle, formant une chaîne polymère. Les atomes de chlore et de vinyle se répètent n fois dans le polymère, il peut donc également être appelé chlorure de polyvinyle (chlorure de polyvinyle, PVC, en anglais).

De plus, c'est un composé moulable, il peut donc être utilisé pour construire de nombreuses pièces de différentes formes et tailles. Le PVC est résistant à la corrosion, principalement en raison de l'oxydation. Par conséquent, il n'y a aucun risque lié à son exposition à l'environnement..
Point négatif, la durabilité du PVC peut être à l'origine d'un problème, car l'accumulation de ses déchets peut contribuer à la pollution environnementale qui affecte tant la planète depuis plusieurs années..
Index des articles
- 1 Histoire du polychlorure de vinyle (PVC)
- 2 Structure chimique
- 3 propriétés
- 3.1 Capacité à retarder le feu
- 3.2 Durabilité
- 3.3 Stabilité mécanique
- 3.4 Traitement et moulabilité
- 3.5 Résistance aux produits chimiques et à l'huile
- 4 propriétés
- 4.1 Densité
- 4.2 Point de fusion
- 4.3 Pourcentage d'absorption d'eau
- 5 utilisations
- 6 Références
Histoire du polychlorure de vinyle (PVC)
En 1838, le physicien et chimiste français Henry V. Regnault découvre le polychlorure de vinyle. Plus tard, le scientifique allemand Eugen Baumann (1872) a exposé une bouteille de chlorure de vinyle à la lumière du soleil et a observé l'apparition d'un matériau blanc solide: c'était du polychlorure de vinyle..
Au début du 20e siècle, le scientifique russe Ivan Ostromislansky et le scientifique allemand Frank Klatte de la société chimique allemande Griesheim-Elektron ont tenté de trouver des applications commerciales pour le polychlorure de vinyle. Ils ont fini par être frustrés, car parfois le polymère était rigide et d'autres fois il était cassant..
En 1926, Waldo Semon, un scientifique travaillant pour B. F. Goodrich Company à Akron, Ohio, a réussi à créer un plastique flexible, imperméable et ignifuge capable de se lier au métal. C'était l'objectif recherché par l'entreprise et c'était la première utilisation industrielle du polychlorure de vinyle..
La fabrication du polymère s'est intensifiée pendant la Seconde Guerre mondiale, car il était utilisé dans le revêtement du câblage des navires de guerre.
Structure chimique
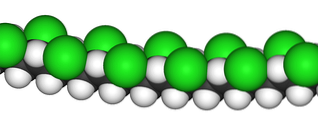
L'image du haut illustre la chaîne polymère du polychlorure de vinyle. Les sphères noires correspondent aux atomes de carbone, les blanches aux atomes d'hydrogène et les vertes aux atomes de chlore.
De ce point de vue, la chaîne a deux surfaces: l'une de chlore et l'autre d'hydrogène. Son agencement tridimensionnel est le plus facilement visualisé à partir du monomère de chlorure de vinyle et de la façon dont il forme des liaisons avec d'autres monomères pour créer la chaîne:
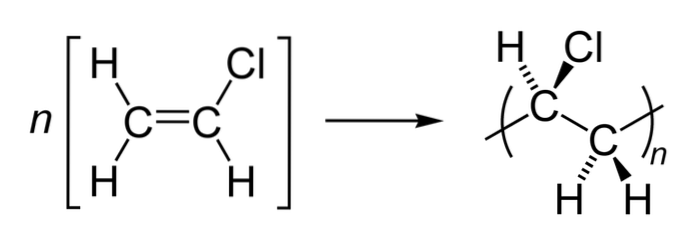
Ici, une chaîne est composée de n unités, placées entre parenthèses. L'atome Cl pointe hors du plan (coin noir), bien qu'il puisse également pointer derrière lui, comme on le voit avec les sphères vertes. Les atomes H sont orientés vers le bas et peuvent être vus de la même manière avec la structure polymère.
Bien que la chaîne n'ait que des liaisons simples, celles-ci ne peuvent pas tourner librement en raison de l'encombrement stérique (spatial) des atomes de Cl..
Parce que? Parce qu'ils sont très encombrants et n'ont pas assez d'espace pour tourner dans d'autres directions. S'ils le faisaient, ils "frapperaient" avec les atomes H voisins.
Propriétés
Capacité à retarder le feu
Cette propriété est due à la présence de chlore. La température d'inflammation du PVC est de 455 ºC, donc le risque de brûlure et d'allumage d'un feu est faible.
De plus, la chaleur dégagée par le PVC lors de la combustion est moindre car elle est produite par le polystyrène et le polyéthylène, deux des matières plastiques les plus utilisées..
Durabilité
Dans des conditions normales, le facteur qui influence le plus la durabilité d'un produit est sa résistance à l'oxydation..
Le PVC a des atomes de chlore attachés aux carbones dans ses chaînes, ce qui le rend plus résistant à l'oxydation que les plastiques qui n'ont que des atomes de carbone et d'hydrogène dans leur structure..
L'examen des tuyaux en PVC enterrés pendant 35 ans, réalisé par la Japan PVC Pipe & Fitting Association, n'a montré aucune détérioration de ceux-ci. Même sa résistance est comparable à celle des nouveaux tuyaux en PVC.
Stabilité mécanique
Le PVC est un matériau chimiquement stable qui présente peu de changement dans sa structure moléculaire et sa résistance mécanique..
C'est un matériau viscoélastique à longue chaîne, susceptible de se déformer par l'application continue d'une force externe. Cependant, sa déformation est faible, car elle présente une limitation de sa mobilité moléculaire..
Traitement et moulabilité
Le traitement d'un matériau thermoplastique dépend de sa viscosité lorsqu'il est fondu ou fondu. Dans ces conditions, la viscosité du PVC est élevée, son comportement dépendant peu de la température et il est stable. Pour cette raison, le PVC peut fabriquer des produits de grande taille et de formes variables..
Résistance aux produits chimiques et à l'huile
Le PVC est résistant aux acides, aux alcalis et à presque tous les composés inorganiques. Le PVC se déforme ou se dissout dans les hydrocarbures aromatiques, les cétones et les éthers cycliques, mais résiste à d'autres solvants organiques tels que les hydrocarbures aliphatiques et les hydrocarbures halogénés. De plus, sa résistance aux huiles et aux graisses est bonne.
Propriétés
Densité
1,38 g / cm3
Point de fusion
Entre 100 ºC et 260 ºC.
Pourcentage d'absorption d'eau
0% en 24 heures
En raison de sa composition chimique, le PVC est capable de se mélanger avec des nombres composites lors de sa fabrication..
Ensuite, en faisant varier les plastifiants et additifs utilisés à cette étape, différents types de PVC peuvent être obtenus avec une gamme de propriétés, telles que la flexibilité, l'élasticité, la résistance aux chocs et la prévention de la croissance bactérienne, entre autres..
Applications
Le PVC est un matériau peu coûteux et polyvalent utilisé dans la construction, la santé, l'électronique, les automobiles, les tuyaux, les revêtements, les poches de sang, les sondes en plastique, l'isolation des câbles, etc..
Il est utilisé dans de nombreux aspects de la construction en raison de sa résistance, de sa résistance à l'oxydation, à l'humidité et à l'abrasion. Le PVC est idéal pour le bardage, pour les cadres de fenêtres, les toits et les clôtures.
Il a été particulièrement utile dans la construction de tuyaux, car ce matériau ne subit pas de corrosion et son taux de rupture n'est que de 1% de celui des systèmes en métal fondu..
Résiste aux changements de température et d'humidité, pouvant être utilisé dans le câblage constituant son revêtement.
Le PVC est utilisé dans l'emballage de différents produits, tels que des dragées, des capsules et d'autres articles à usage médical. De même, les poches de banque de sang sont en PVC transparent.
Parce que le PVC est abordable, durable et imperméable, il est idéal pour les imperméables, les bottes et les rideaux de douche..
Les références
- Wikipédia. (2018). Chlorure de polyvinyle. Extrait le 1 mai 2018 de: en.wikipedia.org
- Les rédacteurs de l'Encyclopaedia Britannica. (2018). Chlorure de polyvinyle. Extrait le 1 mai 2018 de: britannica.com
- Arjen Sevenster. L'histoire du PVC. Extrait le 1 mai 2018 de: pvc.org
- Arjen Sevenster. Propriétés physiques du PVC. Extrait le 1 mai 2018 de: pvc.org
- Fédération britannique des plastiques. (2018). PVC de chlorure de polyvinyle. Extrait le 1 mai 2018 de: bpf.co.uk
- International Polymer Solutions Inc. Propriétés du polychlorure de vinyle (PVC). [PDF]. Extrait le 1 mai 2018 de: ipolymer.com
- ChemicalSafetyFacts. (2018). Chlorure de polyvinyle. Extrait le 1 mai 2018 de: Chemicalsafetyfacts.org
- Paul Goyette. (2018). Tubes en plastique. [Chiffre]. Extrait le 1 mai 2018 de: commons.wikimedia.org

Personne n'a encore commenté ce post.