
Propriétés physiques et chimiques de l'eau

le propriétés physiques et chimiques de l'eau Ce sont toutes ces manifestations de l'eau que l'on peut mesurer grâce aux interactions de ses molécules avec elles-mêmes ou avec leur environnement. Mais qu'est-ce que l'eau? L'eau est une substance chimique ou une molécule formée par l'union d'un atome d'oxygène (O) avec deux atomes d'hydrogène (H).
Ces trois atomes sont maintenus ensemble par la formation de liaisons covalentes, des liaisons de type très fortes et stables. La molécule d'eau a la formule HdeuxOu, il peut être écrit comme H-O-H. C'est cette molécule, ses liaisons et leurs interactions qui en font une substance liquide incolore et insipide..

L'eau est en grande partie distribuée sur toute la Terre, entre l'eau douce et l'eau salée. L'eau est essentielle à la vie sur notre planète, car c'est une ressource naturelle très précieuse. On la retrouve entre 60 à 70% dans les organismes vivants, ce qui est une proportion élevée qui leur permet de remplir d'innombrables fonctions.
Certaines de ces fonctions vitales comprennent les fonctions structurelles, réglementaires, telles que le maintien de la température corporelle et la régulation du pH (acidité ou alcalinité) dans les limites normales. De même, l'eau assure le transport des nutriments et des déchets chez les êtres vivants.
Il est également utilisé dans de nombreux domaines de la routine productive, technologique, scientifique et quotidienne de l'être humain; du nettoyage, de la cuisson des aliments, entre autres utilisations.
Index des articles
- 1 Propriétés physiques de l'eau
- 1.1 Goût
- 1.2 Apparence
- 1.3 États de l'eau
- 1.4 Densité
- 1.5 Point de congélation
- 1.6 Point d'ébullition
- 1.7 Conductivité électrique
- 1.8 Cohésion
- 1.9 Adhésion
- 1.10 Tension superficielle
- 1.11 Capillarité
- 1.12 Action du solvant
- 2 Propriétés chimiques de l'eau
- 2.1 Nature chimique
- 2.2 Polarité
- 2.3 Ionisation
- 2.4 Capacité réactive
- PH 2,5
- 2.6 Amphotéricisme
- 3 Références
Propriétés physiques de l'eau
Les propriétés physiques de l'eau sont liées aux caractéristiques ou aux grandeurs qui peuvent être mesurées ou déterminées lorsque l'on considère la matière, comme sa masse, son énergie, entre autres..
Parmi les grandeurs physiques de l'eau, il y a sa couleur, son odeur, les formes sous lesquelles elle se trouve, et toutes celles que l'on peut déterminer sans produire de réactions ni altérer sa composition chimique..
Goût
Lorsque nous goûtons un peu d'eau pure, notre palais constate qu'elle est insipide ou insipide. Il est également inodore ou inodore. En raison du processus de purification, vous pouvez parfois percevoir une légère odeur due aux résidus de chlore. Ce sont les minéraux qui donnent à l'eau des cartes de saveurs différentes.
Apparence

L'eau en général est incolore et transparente lorsqu'elle est vue dans un bécher en verre. Cependant, il semble avoir une légère couleur bleu clair lorsqu'il est accumulé en grandes quantités dans de grands conteneurs, ou lorsqu'il est observé sur les glaciers, les rivières ou les mers..
Et c'est qu'en fait, l'eau présente une certaine coloration bleutée pâle, dont la perception se concentre plus la quantité d'eau est grande..
États de l'eau
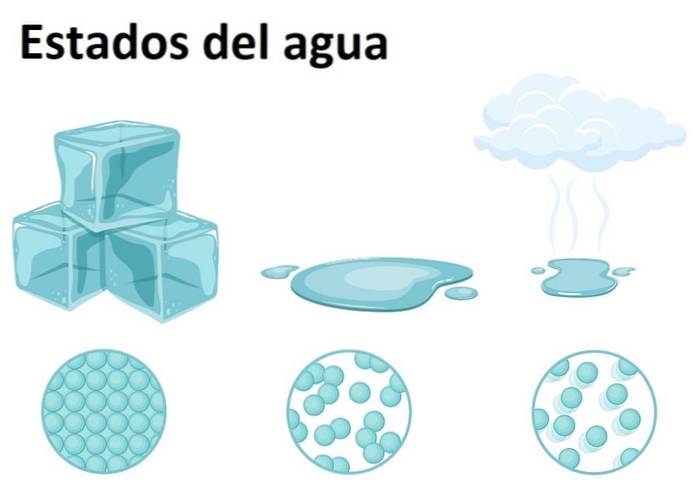
L'eau est très abondante sur Terre et peut être trouvée dans l'un des trois états de la matière: solide, liquide ou gazeux. L'eau à température ambiante est une substance liquide, qui correspond à sa forme la plus courante.
En tant que solide, l'eau est appelée glace ou neige, selon la taille de ses cristaux et le processus de leur formation. Pendant ce temps, l'état gazeux se forme lorsque l'eau passe d'un état liquide à un état gazeux, formant la fameuse vapeur d'eau, facilement reconnaissable dans la cuisine et sur les aliments..
Densité
La densité de l'eau pure est d'environ 1 g / cm3. Pendant ce temps, la densité de l'eau de mer est un peu plus élevée en raison du sel qu'elle contient..
Point de congélation
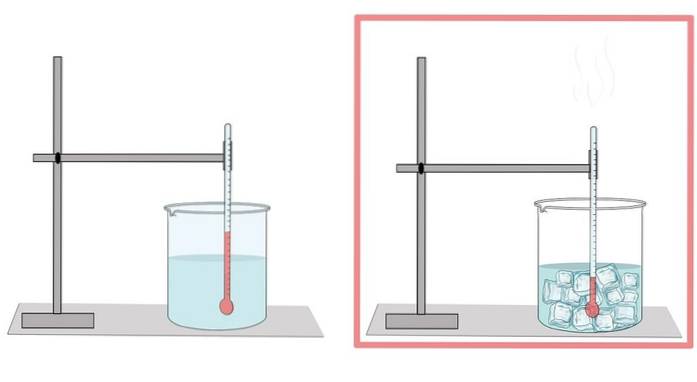
L'eau gèle à 0 ° C. A cette température, il passe de sa phase liquide à la phase solide. Lorsque l'eau gèle, elle se dilate. C'est pourquoi, sous sa forme solide, il a une densité plus faible que dans son état liquide, ce qui permet à la glace de flotter plus facilement sur l'eau liquide..
C'est aussi la raison pour laquelle lorsque l'eau d'une bouteille est refroidie, elle ne doit pas être trop remplie, car la glace se dilate et finit par casser la bouteille..
Point d'ébullition
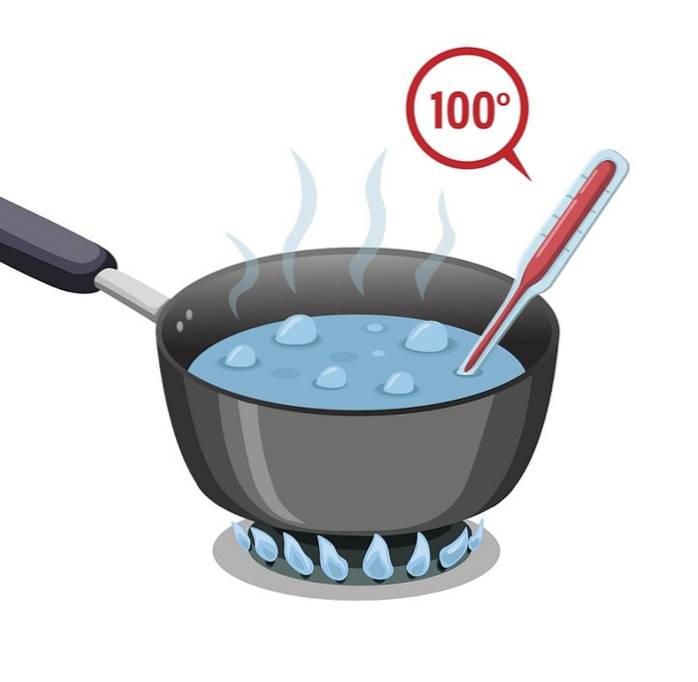
L'eau a un point d'ébullition élevé qui est de 100 ° C. Il doit être soumis à beaucoup de chaleur pour qu'il puisse chauffer et bouillir ou atteindre son point d'ébullition.
L'eau a alors une chaleur spécifique élevée, ou également appelée capacité calorifique, ce qui lui fait mettre du temps à se réchauffer; mais aussi en refroidissement, c'est-à-dire que le processus nécessaire pour perdre la chaleur acquise est lent.
Cette propriété le rend très utile dans les systèmes de réfrigération, dans les systèmes de régulation de la température corporelle, entre autres.
Conductivité électrique
L'eau est un bon conducteur d'électricité. Quelle que soit la pureté de l'eau, elle contiendra toujours une certaine quantité d'ions, ce qui lui confère la propriété d'avoir l'une des constantes diélectriques les plus élevées parmi les liquides non métalliques..
Cohésion
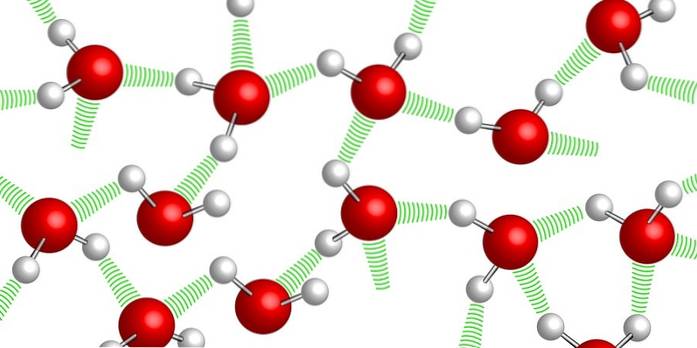
Les molécules d'eau sont maintenues ensemble grâce aux soi-disant liaisons hydrogène: des liaisons faibles qui s'établissent entre l'une et l'autre molécule d'eau. En raison de ce haut niveau de cohésion, il est très difficile de comprimer l'eau.
Accession

Il est facile pour l'eau d'adhérer, par exemple, à la surface très propre d'un verre, formant un film que nous appelons humidité ou "humide". De plus, l'eau adhère rapidement à notre peau, de sorte que nous nous mouillons dès qu'il pleut ou que nous entrons dans une piscine. Sinon nous serions secs en quelques secondes.
Tension superficielle
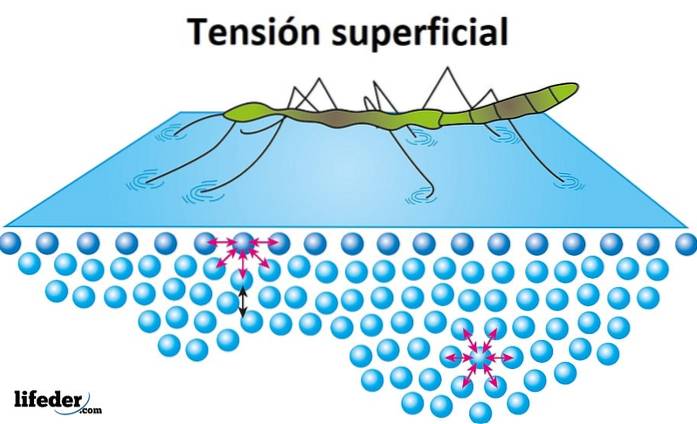
La tension superficielle est la résistance offerte par le liquide sur sa surface à pénétrer. L'eau a une tension superficielle élevée, un produit de la cohésion qui existe entre ses molécules, ce qui lui permet de former facilement des gouttes au lieu de s'étaler librement sur une surface lisse..
La tension superficielle est évidente lorsque les insectes semblent se déplacer ou marcher sur l'eau sans couler, et c'est la raison pour laquelle certaines feuilles ou d'autres objets légers peuvent flotter sur l'eau..
Capillarité

La facilité avec laquelle l'eau monte ou descend d'un tube capillaire décrit la propriété capillaire de l'eau. Cette propriété est également due aux propriétés de cohésion et d'adhérence élevées de l'eau..
La capillarité est utilisée par la nature végétale pour fournir de l'eau aux feuilles des branches les plus hautes d'un arbre, ainsi que pour faciliter son absorption par les racines des plantes..
De même, les propriétés de tension superficielle et de capillarité signifient que l'eau est une partie structurelle des cellules, qu'elle fait partie du sang et qu'elle coule ou s'écoule facilement à travers les différents vaisseaux sanguins..
Action du solvant

L'eau peut dissoudre de nombreuses substances, ce qui est vital pour les organismes vivants, car toutes les réactions chimiques chez les êtres vivants ont lieu en milieu aqueux. Dans les organismes vivants, il sert à transporter des nutriments, des ions et de nombreuses autres substances.
Il sert également au transport des déchets, tels que l'urée, qui est éliminée dans l'eau de l'urine. Lorsqu'une substance se dissout et se mélange bien avec l'eau, on dit qu'elle est hydrophile ou soluble dans l'eau. Si elle ne se mélange pas ou ne se dissout pas bien, la substance est dite hydrophobe ou insoluble dans l'eau.
Propriétés chimiques de l'eau
Les propriétés ou caractéristiques chimiques sont celles qui se produisent lorsque des changements se produisent dans la structure chimique de l'eau. Il est donc important de jeter un bref coup d'œil à sa structure moléculaire..
Nature chimique
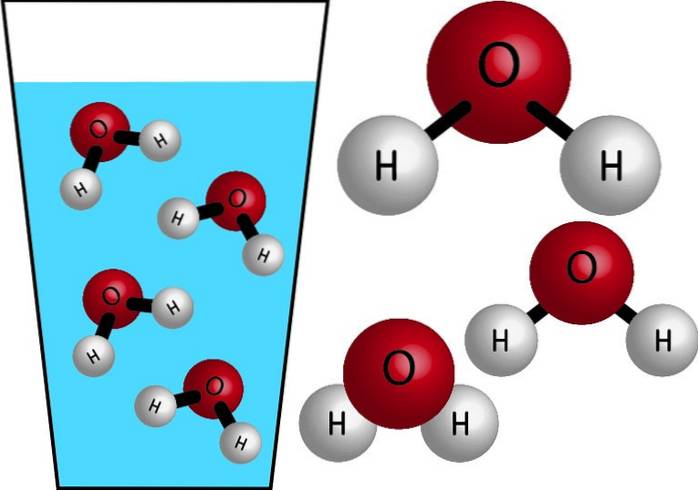
L'eau est une molécule inorganique, car elle ne contient pas de C (carbone) et sa formule chimique est HdeuxO. Leurs atomes se rejoignent en partageant des électrons, formant des liaisons covalentes, des liaisons fortes et très stables. Sa masse molaire est de 18 g / mol, c'est-à-dire qu'une mole d'eau a une masse de 18 grammes.
Polarité
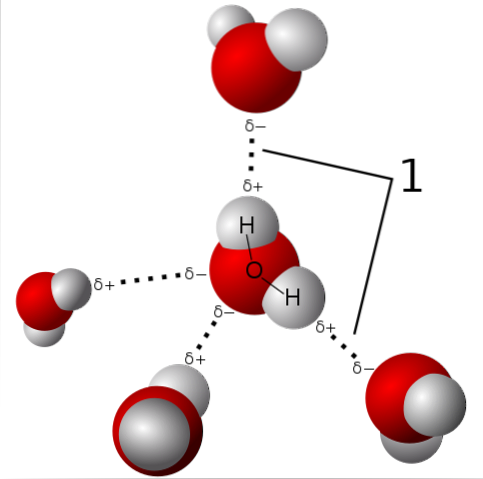
La molécule d'eau est neutre, mais a une certaine polarité, car le partage de ses électrons n'est pas si équitable.
Comme l'oxygène attire les électrons partagés vers lui avec plus de force, la molécule d'eau reste avec ce côté où se trouve l'oxygène, avec une tendance à avoir une certaine charge négative; et par conséquent, il reste avec une charge partielle positive vers l'endroit où se trouvent les hydrogènes (voir l'image du haut).
Cette polarité facilite l'union des molécules d'eau entre elles et l'union de l'eau avec d'autres molécules qui ont également des différences de charge dans leur structure, ce qui favorise les propriétés physiques décrites dans les sections précédentes..
Ionisation
Spontanément dans l'eau liquide, il y a une légère ionisation ou auto-dissociation. Cela signifie que certaines de ses molécules sont réorganisées en modifiant leur structure moléculaire normale, générant de nouvelles molécules chargées électriquement, telles que les ions hydronium (H3OU ALORS+) et hydroxyle (OH-).
Capacité réactive
L'eau réagit avec de nombreuses substances, formant une grande diversité de composés chimiques. Par électrolyse, l'eau peut se décomposer, séparant l'oxygène de ses deux hydrogènes. Ce processus se produit lorsqu'un courant électrique traverse l'eau. Même l'eau sous sa forme solide peut également faire partie de certaines réactions chimiques.
pH

L'eau pure a un pH neutre (égal à 7), tandis que l'eau de mer est légèrement alcaline (supérieure à 7). L'eau de pluie devient légèrement acide (pH inférieur à 7) lorsqu'elle se mélange avec des composants présents dans l'atmosphère, tels que le dioxyde de carbone ou le CO.deux, par exemple.
Amphotéricisme
L'eau est amphotère, c'est-à-dire qu'elle peut se comporter comme un acide ou comme une base en fonction du pH de la solution. Cette propriété chimique soutient son rôle de régulateur de pH..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Castillero M. O. (2020). Psychologie et esprit. Les 15 propriétés physiques et chimiques de l'eau. Récupéré de: psicologiaymente.com
- Wikipédia (2020). Propriétés de l'eau. Récupéré de: en.wikipedia.org
- Sharp K. A. (s.f.). L'eau: structure et propriétés. Récupéré de: crystal.med.upenn.edu
- BYJU'S. (s.f.). Propriétés physiques et chimiques de l'eau. Récupéré de: byjus.com
- Énergie et environnement scolaire. (s.f.). L'eau était une ressource. Récupéré de: eniscuola.net

Personne n'a encore commenté ce post.