
Qu'est-ce que la densité électronique?
La Densité d'électron c'est une mesure de la probabilité de trouver l'électron dans une région donnée de l'espace; soit autour d'un noyau atomique, soit dans les «voisinages» des structures moléculaires.
Plus la concentration d'électrons en un point donné est élevée, plus la densité électronique est élevée, et par conséquent, il se distinguera de son environnement et présentera certaines caractéristiques qui expliquent la réactivité chimique. Une manière excellente et graphique de représenter un tel concept est carte de potentiel électrostatique.

Par exemple, l'image supérieure montre la structure de l'énantiomère S-carnitine avec sa carte de potentiel électrostatique correspondante. Une échelle composée des couleurs de l'arc-en-ciel peut être observée: rouge pour indiquer la région avec la densité électronique la plus élevée, et bleu pour cette région pauvre en électrons..
Au fur et à mesure que la molécule est parcourue de gauche à droite, on s'éloigne du groupe -COdeux- vers le squelette CHdeux-CHOH-CHdeux, où les couleurs sont jaune et vert, indiquant une diminution de la densité électronique; jusqu'au groupe -N (CH3)3+, la région d'électrons la plus pauvre, colorée en bleu.
Généralement, les régions où la densité électronique est faible (celles colorées en jaune et en vert) sont les moins réactives dans une molécule..
Index des articles
- 1 Concept
- 2 Carte de potentiel électrostatique
- 2.1 Comparaison des couleurs
- 2.2 Réactivité chimique
- 3 Densité électronique dans l'atome
- 4 Références
Concept
Plus que chimique, la densité électronique est de nature physique, car les électrons ne restent pas statiques, mais se déplacent d'un côté à l'autre créant des champs électriques..
Et la variation de ces champs provoque les différences de densités d'électrons dans les surfaces de van der Waals (toutes ces surfaces de sphères).
La structure de la S-carnitine est représentée par un modèle de sphères et de barres, mais si c'était par sa surface de van der Waals, les barres disparaîtraient et seul un ensemble de sphères collées serait observé (avec les mêmes couleurs).
Les électrons sont plus susceptibles d'être autour des atomes les plus électronégatifs; cependant, il peut y avoir plus d'un atome électronégatif dans la structure moléculaire, et donc des groupes d'atomes qui exercent également leur propre effet inductif.
Cela signifie que le champ électrique varie plus que ce qui peut être prédit en observant une molécule à vol d'oiseau; c'est-à-dire qu'il peut y avoir plus ou moins de polarisation des charges négatives ou de la densité électronique.
Cela peut également s'expliquer comme suit: la répartition de la charge devient plus homogène.
Carte de potentiel électrostatique
Par exemple, parce que le groupe -OH a un atome d'oxygène, il attire la densité électronique de ses atomes voisins; cependant, dans la S-carnitine, il cède une partie de sa densité électronique au groupe -COdeux-, tout en quittant le groupe -N (CH3)3+ avec une plus grande déficience électronique.
Notez qu'il peut être très difficile de déduire comment les effets inductifs fonctionnent dans une molécule complexe, telle qu'une protéine..
Afin d'avoir une vue d'ensemble à portée de main de ces différences dans les champs électriques dans la structure, le calcul informatique des cartes de potentiel électrostatique est utilisé..
Ces calculs consistent à placer une charge ponctuelle positive et à la déplacer le long de la surface de la molécule; là où il y a moins de densité électronique, il y aura répulsion électrostatique, et plus la répulsion est élevée, plus la couleur bleue sera intense.
Là où la densité électronique est plus élevée, il y aura une forte attraction électrostatique, représentée par la couleur rouge.
Les calculs prennent en compte tous les aspects structuraux, les moments dipolaires des liaisons, les effets inductifs provoqués par tous les atomes hautement électronégatifs, etc. Et en conséquence, vous obtenez ces surfaces colorées et visuellement attrayantes..
Comparaison des couleurs
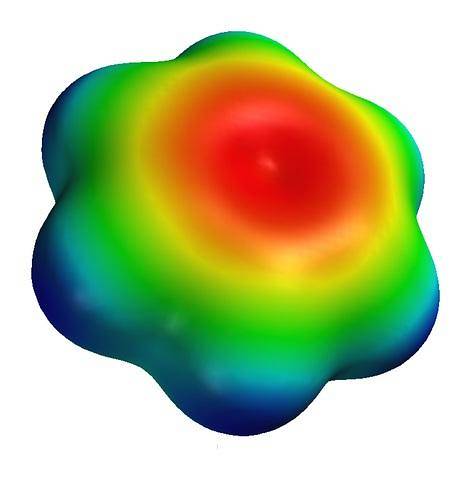
Ci-dessus, la carte de potentiel électrostatique pour une molécule de benzène. Notez qu'au centre de l'anneau il y a une densité d'électrons plus élevée, tandis que ses "pointes" sont de couleur bleuâtre, en raison des atomes d'hydrogène moins électronégatifs. De même, cette répartition des charges est due au caractère aromatique du benzène.
Sur cette carte, les couleurs verte et jaune sont également observées, indiquant les approximations des régions pauvres et riches en électrons..
Ces couleurs ont leur propre échelle, différente de celle de la S-carnitine; et par conséquent, il est incorrect de comparer le groupe -COdeux- et le centre de l'anneau aromatique, tous deux représentés par la couleur rouge sur leurs cartes.
S'ils gardaient tous les deux la même échelle de couleurs, la couleur rouge sur la carte du benzène deviendrait légèrement orange. Dans le cadre de cette standardisation, les cartes de potentiel électrostatique, et donc les densités d'électrons de diverses molécules, peuvent être comparées..
Sinon, la carte ne servirait qu'à connaître les distributions de charge pour une molécule individuelle..
Réactivité chimique
En observant une carte du potentiel électrostatique, et donc des régions avec des densités d'électrons élevées et faibles, on peut prédire (mais pas dans tous les cas) où des réactions chimiques se produiront dans la structure moléculaire..
Les régions à haute densité électronique sont capables de «fournir» leurs électrons aux espèces environnantes qui en ont besoin ou qui en ont besoin; à ces espèces, chargé négativement, E+, ils sont connus comme électrophiles.
Par conséquent, les électrophiles peuvent réagir avec les groupes représentés par la couleur rouge (le -COdeux- et le centre du cycle benzénique).
Alors que les régions à faible densité d'électrons, réagissent avec des espèces chargées négativement, ou avec celles qui ont des paires d'électrons libres à partager; ces derniers sont appelés nucléophiles.
Dans le cas du -N (CH3)3+, il réagira de telle manière que l'atome d'azote gagne des électrons (réduit).
Densité électronique dans l'atome
Dans l'atome, les électrons se déplacent à des vitesses énormes et peuvent être dans plusieurs régions de l'espace en même temps.
Cependant, à mesure que la distance du noyau augmente, les électrons acquièrent de l'énergie potentielle électronique et leur distribution probabiliste diminue..
Cela signifie que les nuages électroniques d'un atome n'ont pas de frontière définie, mais une frontière floue. Par conséquent, il n'est pas facile de calculer le rayon atomique; Sauf s'il y a des voisins qui établissent une différence dans les distances de leurs noyaux, dont la moitié peut être prise comme le rayon atomique (r = d / 2).
Les orbitales atomiques et leurs fonctions d'onde radiale et angulaire démontrent comment la densité électronique change en fonction de la distance qui les sépare du noyau..
Les références
- Reed College. (s.f.). Qu'est-ce que la densité électronique? ROCO. Récupéré de: reed.edu
- Wikipédia. (2018). Densité d'électron. Récupéré de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11 juin 2014). Définition de la densité électronique. Récupéré de: thinkco.com
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: densité électronique. Récupéré de: chem.ucla.edu
- Chimie LibreTexts. (29 novembre 2018). Tailles atomiques et distributions de densité électronique. Récupéré de: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.

Personne n'a encore commenté ce post.