
Quelles sont les forces de Van der Waals?
le Les forces de Van der Waals ce sont des forces intermoléculaires de nature électrique qui peuvent être attractives ou répulsives. Il existe une interaction entre les surfaces des molécules ou des atomes, différente par essence des liaisons ioniques, covalentes et métalliques qui se forment à l'intérieur des molécules..
Bien que faibles, ces forces sont capables d'attirer des molécules de gaz; aussi celui des gaz liquéfiés et solidifiés et ceux de tous les liquides et solides organiques. Johannes Van der Waals (1873) est celui qui a développé une théorie pour expliquer le comportement des gaz réels.

Dans l'équation de Van der Waals pour les gaz réels - (P + àndeux/ Vdeux) (V - nb)) = nRT- deux constantes sont introduites: la constante b (c'est-à-dire le volume occupé par les molécules de gaz) et «a», qui est une constante empirique.
La constante «a» corrige l'écart par rapport au comportement attendu des gaz idéaux à basse température, précisément là où s'exprime la force d'attraction entre les molécules de gaz. La capacité d'un atome à se polariser dans le tableau périodique augmente du haut d'un groupe au bas du groupe, et de droite à gauche sur une période..
En augmentant le numéro atomique - et donc le nombre d'électrons - ceux qui se trouvent dans les coques extérieures sont plus faciles à déplacer pour former des éléments polaires.
Index des articles
- 1 Interactions électriques intermoléculaires
- 1.1 Interaction entre dipôles permanents
- 1.2 Interaction entre un dipôle permanent et un dipôle induit
- 2 Forces de Londres ou dispersion
- 3 radios Van der Waals
- 4 Forces et énergie de l'interaction électrique entre les atomes et entre les molécules
- 5 Références
Interactions électriques intermoléculaires
Interaction entre dipôles permanents
Il existe des molécules électriquement neutres, qui sont des dipôles permanents. Ceci est dû à une perturbation de la distribution électronique qui produit une séparation spatiale des charges positives et négatives vers les extrémités de la molécule, constituant un dipôle (comme s'il s'agissait d'un aimant).
L'eau est composée de 2 atomes d'hydrogène à une extrémité de la molécule et d'un atome d'oxygène à l'autre extrémité. L'oxygène a une plus grande affinité pour les électrons que l'hydrogène et les attire.
Cela produit un déplacement d'électrons vers l'oxygène, laissant cette charge négative et l'hydrogène avec une charge positive..

La charge négative d'une molécule d'eau peut interagir électrostatiquement avec la charge positive d'une autre molécule d'eau provoquant une attraction électrique. Ainsi, ce type d'interaction électrostatique est appelé forces de Keesom.
Interaction entre un dipôle permanent et un dipôle induit
Le dipôle permanent a ce qu'on appelle un moment dipolaire (µ). L'amplitude du moment dipolaire est donnée par l'expression mathématique:
µ = q.x
q = charge électrique.
x = distance spatiale entre les pôles.
Le moment dipolaire est un vecteur qui, par convention, est représenté orienté du pôle négatif au pôle positif. La magnitude de µ fait mal à exprimer en debye (3,34 × 10-30 Cm.
Le dipôle permanent peut interagir avec une molécule neutre provoquant une altération de sa distribution électronique, entraînant un dipôle induit dans cette molécule.
Le dipôle permanent et le dipôle induit peuvent interagir électriquement, produisant une force électrique. Ce type d'interaction est appelé induction et les forces qui y agissent sont appelées forces de Debye..
Forces de Londres ou dispersion
La nature de ces forces attractives est expliquée par la mécanique quantique. Londres a postulé qu'en un instant, dans les molécules électriquement neutres, le centre des charges négatives des électrons et le centre des charges positives des noyaux pourraient ne pas coïncider..
Ainsi, la fluctuation de la densité électronique permet aux molécules de se comporter comme des dipôles temporaires.
Ce n'est pas en soi une explication des forces d'attraction, mais des dipôles temporaires peuvent induire une polarisation correctement alignée des molécules adjacentes, entraînant la génération d'une force d'attraction. Les forces d'attraction générées par les fluctuations électroniques sont appelées forces de Londres ou dispersion..
Les forces de Van der Waals montrent une anisotropie, c'est pourquoi elles sont influencées par l'orientation des molécules. Cependant, les interactions de type dispersion sont toujours principalement attractives..
Les forces de Londres se renforcent à mesure que la taille des molécules ou des atomes augmente.
Dans les halogènes, les molécules Fdeux et Cldeux les nombres atomiques faibles sont des gaz. Le BRdeux avec le numéro atomique le plus élevé est un liquide et le Ideux, l'halogène ayant le numéro atomique le plus élevé est un solide à température ambiante.
L'augmentation du numéro atomique augmente le nombre d'électrons présents, ce qui facilite la polarisation des atomes et, par conséquent, les interactions entre eux. Cela détermine l'état physique des halogènes.
Radios Van der Waals
Les interactions entre molécules et entre atomes peuvent être attractives ou répulsives, selon une distance critique entre leurs centres, appelée rv.
À des distances entre molécules ou atomes supérieures à rv, l'attraction entre les noyaux d'une molécule et les électrons de l'autre prédomine sur les répulsions entre les noyaux et les électrons des deux molécules.
Dans le cas décrit, l'interaction est attractive, mais que se passe-t-il si les molécules s'approchent à une distance entre leurs centres inférieure à rv? Alors la force répulsive prédomine sur la force attractive, qui s'oppose à une approche plus rapprochée entre les atomes..
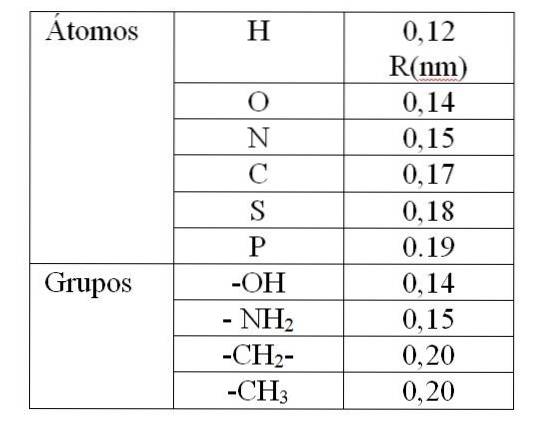
La valeur de rv Il est donné par les soi-disant rayons de Van der Waals (R). Pour les molécules sphériques et identiques rv égale 2R. Pour deux molécules différentes de rayons R1 et Rdeux: rv est égal à R1 + Rdeux. Les valeurs des rayons de Van der Waals sont données dans le tableau 1.
La valeur donnée dans le tableau 1 indique un rayon de Van der Waals de 0,12 nm (10-9 m) pour l'hydrogène. Alors la valeur de rv pour cet atome, il est de 0,24 nm. Pour une valeur de rv moins de 0,24 nm produira une répulsion entre les atomes d'hydrogène.
Forces et énergie de l'interaction électrique entre les atomes et entre les molécules
La force entre une paire de charges q1 et alorsdeux, séparé dans le vide par la distance r, est donné par la loi de Coulomb.
F = k. quelle1.quelledeux/ rdeux
Dans cette expression, k est une constante dont la valeur dépend des unités utilisées. Si la valeur de la force - donnée par l'application de la loi de Coulomb - est négative, cela indique une force attractive. Au contraire, si la valeur donnée pour la force est positive, elle indique une force répulsive.
Les molécules étant généralement dans un milieu aqueux qui protège les forces électriques exercées, il est nécessaire d'introduire le terme de constante diélectrique (ε). Ainsi, cette constante corrige la valeur donnée pour les forces électriques par l'application de la loi de Coulomb.
F = k.q1.quelledeux/ε.rdeux
De même, l'énergie pour l'interaction électrique (U) est donnée par l'expression:
U = k. quelle1.quelledeux/ε.r
Les références
- Les rédacteurs de l'Encyclopaedia Britannica. (2018). Forces de Van der Waals. Extrait le 27 mai 2018 de: britannica.com
- Wikipédia. (2017). Forces de Van der Waals. Extrait le 27 mai 2018 de: es.wikipedia.org
- Kathryn Rashe, Lisa Peterson, Seila Buth, Irene Ly. Forces de Van der Waals. Extrait le 27 mai 2018 de: chem.libretexts.org
- Morris, J. G. (1974) Chimie physique d'un biologiste. 2et édition. Edward Arnold (éditeurs) Limited.
- Mathews, C. K., Van Holde, K.E. et Ahern, K.G. (2002) Biochimie. Troisième édition. Addison Wesley Longman, Inc.



Personne n'a encore commenté ce post.