
Que sont les fonctions chimiques inorganiques?
le fonctions chimiques inorganiques sont ces familles de composés inorganiques qui partagent des caractéristiques chimiques similaires. Ces fonctions chimiques sont constituées de cinq groupes: oxydes, bases ou hydroxydes, acides, sels et hydrures..
Chaque fonction chimique est définie par un ensemble d'atomes qui les identifie. De cette manière, il devient possible d'identifier la fonction à laquelle appartient un composé chimique en fonction de ses éléments..

En ce sens, on peut affirmer que le groupe OH définit la fonction chimique de l'hydroxyde. Par conséquent, NaOH (hydroxyde de sodium) appartiendra au groupe des hydroxydes.
Les fonctions chimiques inorganiques utilisent des composés chimiques d'origine minérale. Le sel, l'eau, l'or, le plomb, le gypse et le talc sont quelques exemples de composés inorganiques utilisés au quotidien..
Tous les composés inorganiques existaient sur la planète Terre avant l'apparition de la vie. Avec la théorie atomique, le développement du tableau périodique et la radiochimie, il a été possible de définir les cinq fonctions de la chimie inorganique.
Les premières recherches et approches sur le sujet ont eu lieu au début du XIXe siècle et reposaient sur l'étude de composés inorganiques simples (sels et gaz)..
Index des articles
- 1 Fonctions chimiques inorganiques
- 1.1 - Oxydes
- 1.2 - Bases ou hydroxydes
- 1.3 - Acides
- 1.4 - Sels
- 1.5 - Hydrures
- 2 Références
Fonctions chimiques inorganiques
- Oxydes

Les oxydes sont des composés doubles ou binaires dans lesquels un ou plusieurs atomes d'oxygène sont combinés avec d'autres éléments. Pour cette raison, il existe de nombreux types d'oxydes dans différents états de la matière (solide, liquide et gazeux).
L'oxygène contribue toujours à un état d'oxydation de -2, et presque tous les éléments qui s'y combinent donnent naissance à des composés stables à différents degrés d'oxydation..
Grâce à ceux-ci, les composés obtenus présentent des propriétés variées et peuvent présenter à la fois des liaisons ioniques covalentes et solides..
Oxydes basiques
Les oxydes basiques sont des composés dérivés du mélange d'oxygène avec un métal (de transition, alcalino-terreux ou alcalin). Par exemple, la combinaison de magnésium et d'oxygène donne un oxyde basique, comme ceci:
2Mg + O2 → 2 MgO
Métal + oxygène = oxyde basique
2MgO = oxyde basique
Nomenclature
La nomenclature des oxydes est toujours la même. Tout d'abord, le nom générique du composé (oxyde) est indiqué, puis le nom du métal est écrit. Cela se produit tant que la valence du métal est fixe.
Un exemple peut être l'oxyde de sodium ou Na2O, où le symbole du métal passe en premier, puis celui de l'oxygène avec sa valence ou son état d'oxydation de -2.
Dans le cas des oxydes basiques, il existe trois types de nomenclature: la traditionnelle, l'atomique et le chiffre Stock. Le nom de chaque oxyde basique dépendra de la valence ou du nombre d'oxydation de chaque élément.
Caractéristiques
- Ils sont toujours formés en combinant n'importe quel élément avec de l'oxygène.
- Les oxydes binaires sont ceux qui sont obtenus en mélangeant de l'oxygène avec un autre élément.
- Pour obtenir un oxyde ternaire ou mixte, un composé binaire doit être combiné avec de l'eau (H2O).
- Il existe des oxydes mixtes résultant de la combinaison de deux éléments différents avec de l'oxygène.
- Bases ou hydroxydes

Leur goût est amer, leur texture savonneuse au toucher, ils sont de bons conducteurs de courant électrique lorsqu'ils sont dans une solution aqueuse, ils sont corrosifs et lorsqu'ils touchent du papier de tournesol, ils le font passer du rose au bleu..
Caractéristiques
- Ils sont dérivés du mélange d'un oxyde basique avec de l'eau.
- Les substances qu'ils créent peuvent recevoir des protons.
- Ce sont des conducteurs d'électricité appelés électrolytes.
- Ils sont solubles dans l'eau lorsqu'ils entrent en contact avec celle-ci.
- Son goût est amer.
- Ils sont corrosifs pour la peau.
- Acides

Les acides sont des composés inorganiques qui résultent du mélange d'hydrogène avec tout élément ou groupe d'éléments à haute électronégativité.
Ils peuvent être facilement identifiés par leur goût acide, car ils peuvent brûler la peau lorsqu'ils entrent en contact direct avec elle, et en raison de leur capacité à changer la couleur du papier de tournesol du bleu au rose..
Hydracides
Les hydracides sont un groupe d'acides dérivés de la combinaison de l'hydrogène avec un non-métal. Un exemple peut être la combinaison de chlore et d'hydrogène qui donne de l'acide chlorhydrique, comme ceci:
Cl2 + H2 → 2HCL
Non-métal + hydrogène = hydracide
H2CL = Hydracide
Oxacides
Les oxydes sont un groupe d'acides dérivés de la combinaison de l'eau avec un oxyde d'acide. Un exemple peut être la combinaison de trioxyde de soufre avec de l'eau qui donne de l'acide sulfurique, comme ceci:
SO3 + H2O → H2SO4
Oxyde acide + eau = Oxacide
H2SO4 = Oxacide
Caractéristiques
- Ils brûlent la peau car ils sont corrosifs.
- Sa saveur est aigre.
- Ce sont des conducteurs de courant électrique.
- En réagissant avec une base, ils forment un sel et de l'eau.
- Lorsqu'ils réagissent avec un oxyde métallique, ils forment un sel et de l'eau.
- Vous sortez
Les sels sont des composés dérivés de la combinaison d'une base avec un acide. Ils ont généralement un goût salé et sont à l'état acide.
Ce sont de bons conducteurs électriques dans les solutions aqueuses. Le contact avec le papier de tournesol n'affecte pas sa couleur.
Haloïdes
Les sels haloïdes sont ceux qui manquent d'oxygène et se forment par les réactions suivantes:
1 - Lorsqu'il est mélangé avec un métal halogène. Un exemple peut être la combinaison de magnésium avec de l'acide chlorhydrique pour former du chlorure de magnésium et de l'hydrogène, comme ceci:
Mg + 2HCl → MgCl2 + H2
2 - Lors du mélange d'un métal actif avec un hydracide. Un exemple peut être la combinaison d'acide bromhydrique avec de l'oxyde de sodium, qui donne du bromure de sodium et de l'eau, comme ceci:
2HBr + 2NaO 2 → NaBr + H2O
3 - Lors du mélange d'un hydracide avec un oxyde métallique. Un exemple peut être la combinaison d'acide chlorhydrique avec de l'hydroxyde de sodium pour former du chlorure de sodium et de l'eau, comme ceci:
HCl + NaOH → NaCl + H2O
- Oxisales

Les oxysels sont ces sels qui contiennent de l'oxygène. Ils sont formés comme suit:
1 - Lors du mélange d'un hydracide avec un hydroxyde. C'est un processus de neutralisation. Un exemple peut être le mélange de magnésium avec de l'acide sulfurique pour former du sulfate de magnésium et de l'eau, comme ceci:
Mg + H2SO4 → MgSO4 + H2O
2 - Lors du mélange d'un oxacide avec un métal actif. Un exemple peut être la combinaison d'hydroxyde de calcium avec du dioxyde de carbone pour donner du carbonate de calcium et de l'eau, comme ceci:
Ca (OH) 2 + CO2 → CaCO3 + H2O
3 - Lors du mélange d'un hydroxyde avec un anhydride.
4 - Lors du mélange d'un hydroxyde avec un oxacide. Un exemple pourrait être la combinaison d'acide nitrique avec de l'hydroxyde de baryum pour donner du nitrate de baryum et de l'eau, comme ceci:
2HNO3 + Ba (OH) 2 → Ba (NO3) 2 + 2H2O
Caractéristiques
- Ils ont un goût salé.
- Ils peuvent être acides ou basiques.
- Ce sont de bons conducteurs électriques.
- Hydrures
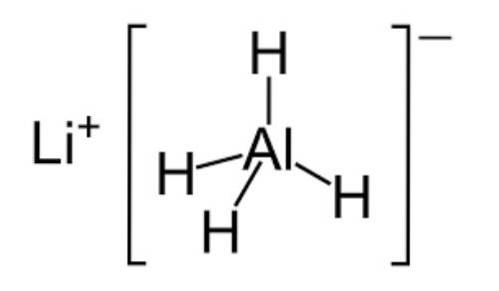
Les hydrures sont des composés chimiques inorganiques composés d'hydrogène et de tout élément non métallique.
Ils sont généralement à l'état gazeux et ont des propriétés similaires à celles des acides. Cependant, il existe certains hydrures spéciaux tels que l'eau (H2O) qui peuvent être à l'état liquide à température ambiante..
Nomenclature
Pour formuler un hydrure, écrivez d'abord le symbole de l'hydrogène puis celui de l'élément.
Pour les nommer, le suffixe uro et la racine non métallique sont ajoutés, spécifiant la présence d'hydrogène. Quelques exemples sont les suivants:
HF = fluorure d'hydrogène
HCl = chlorure d'hydrogène
HBr = bromure d'hydrogène
Les références
- (21 novembre 2011). BuenasTareas.com. Obtenu à partir d'oxydes, d'acides, d'hydroxydes, de sels haloïdes, etc.: goodtasks.com.
- García, R. E. (2007). Fonctions chimiques inorganiques et nomenclature. Éditorial Trillas.
- House, J.E, et House, K. A. (2016). Chimie inorganique descriptive. Londres: Elsevier.
- Vasquez, L. N., et Blanco, W. Y. (25 avril 2013). Chimie. Obtenu à partir d'oxydes, d'hydroxydes, d'acides et de sels: quimicanataliamywendyd.blogspot.com.
- Williams, A. (1979). Une approche théorique de la chimie inorganique. Berlin: Springer - Verlag.

Personne n'a encore commenté ce post.