
Caractéristiques, équations et exemples de réactions endothermiques

Ongle réaction endothermique C'est celui qui pour avoir lieu doit absorber l'énergie, sous forme de chaleur ou de rayonnement, de son environnement. Généralement, mais pas toujours, ils peuvent être reconnus par une baisse de température dans leur environnement; ou au contraire, ils ont besoin d'une source de chaleur, telle que celle obtenue par une flamme allumée.
L'absorption d'énergie ou de chaleur est ce que toutes les réactions endothermiques ont en commun; leur nature, ainsi que les transformations impliquées, sont très diverses. Combien de chaleur doivent-ils absorber? La réponse dépend de sa thermodynamique: la température à laquelle la réaction se produit spontanément.

Par exemple, l'une des réactions endothermiques les plus emblématiques est le changement d'état de la glace à l'eau liquide. La glace a besoin d'absorber la chaleur jusqu'à ce que sa température atteigne environ 0 ° C; à cette température, sa fusion devient spontanée et la glace absorbe jusqu'à ce qu'elle ait complètement fondu.
Dans les espaces chauds, comme sur les rives d'une plage, les températures sont plus élevées et, par conséquent, la glace absorbe la chaleur plus rapidement; c'est-à-dire qu'il fond plus rapidement. La fonte des glaciers est un exemple de réaction endothermique indésirable.
Pourquoi cela se passe-t-il de cette façon? Pourquoi la glace ne peut-elle pas apparaître comme un solide chaud? La réponse réside dans l'énergie cinétique moyenne des molécules d'eau dans les deux états et dans la manière dont elles interagissent entre elles par le biais de leurs liaisons hydrogène..
Dans l'eau liquide, ses molécules ont une plus grande liberté de mouvement que dans la glace, où elles vibrent stationnaires dans ses cristaux. Pour se déplacer, les molécules doivent absorber l'énergie de telle sorte que leurs vibrations rompent les fortes liaisons hydrogène directionnelles dans la glace..
Pour cette raison, la glace absorbe la chaleur pour fondre. Pour que la "glace chaude" existe, les liaisons hydrogène devraient être anormalement fortes pour fondre à une température bien supérieure à 0 ° C..
Index des articles
- 1 Caractéristiques d'une réaction endothermique
- 1,1 ΔH> 0
- 1.2 Ils rafraîchissent leur environnement
- 2 équations
- 3 Exemples de réactions endothermiques courantes
- 3.1 Évaporation de la neige carbonique
- 3.2 Cuisson du pain ou cuisson des aliments
- 3.3 Bain de soleil
- 3.4 Réaction de l'azote atmosphérique et de la formation d'ozone
- 3.5 Electrolyse de l'eau
- 3.6 Photosynthèse
- 3.7 Solutions de certains sels
- 3.8 Décompositions thermiques
- 3.9 Chlorure d'ammonium dans l'eau
- 3.10 Triosulfate de sodium
- 3.11 Moteurs de voiture
- 3.12 Liquides bouillants
- 3.13 Cuire un œuf
- 3.14 Cuisson des aliments
- 3.15 Réchauffer les aliments au micro-ondes
- 3.16 Moulage du verre
- 3.17 Consommation d'une bougie
- 3.18 Nettoyage à l'eau chaude
- 3.19 Stérilisation à la chaleur des aliments et autres objets
- 3.20 Lutte contre les infections avec fièvre
- 3.21 Évaporation de l'eau
- 4 Références
Caractéristiques d'une réaction endothermique
Le changement d'état n'est pas proprement une réaction chimique; cependant, la même chose se produit: le produit (eau liquide) a une énergie plus élevée que le réactif (glace). C'est la caractéristique principale d'une réaction ou d'un processus endothermique: les produits sont plus énergétiques que les réactifs.
Bien que cela soit vrai, cela ne signifie pas que les produits doivent nécessairement être instables. Dans le cas où c'est le cas, la réaction endothermique n'est plus spontanée dans toutes les conditions de température ou de pression..
Considérez l'équation chimique suivante:
A + Q => B
Où Q représente la chaleur, généralement exprimée en unités de joule (J) ou de calories (cal). Comme A absorbe la chaleur Q pour se transformer en B, alors on dit qu'il s'agit d'une réaction endothermique. Ainsi, B a plus d'énergie que A, et doit absorber suffisamment d'énergie pour réaliser sa transformation.
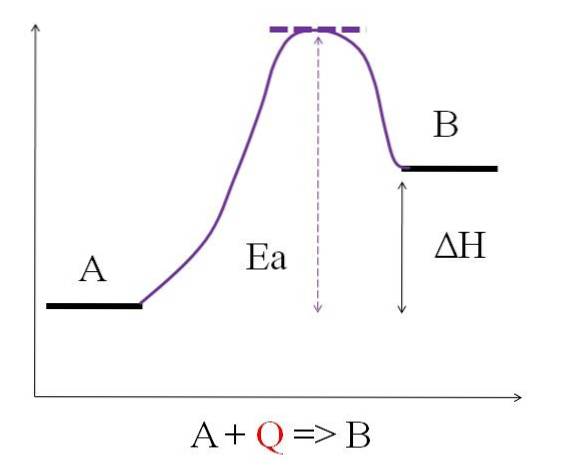
Comme on peut le voir sur le schéma ci-dessus, A a moins d'énergie que B. La quantité de chaleur Q absorbée par A est telle qu'elle surmonte l'énergie d'activation (l'énergie nécessaire pour atteindre le pic violet avec le toit en pointillé). La différence d'énergie entre A et B est connue sous le nom d'enthalpie de la réaction, ΔH.
ΔH> 0
Toutes les réactions endothermiques ont en commun le schéma ci-dessus, car les produits sont plus énergétiques que les réactifs. Par conséquent, la différence d'énergie entre eux, ΔH, est toujours positive (HProduit-HRéactif > 0). Comme cela est vrai, il doit y avoir une absorption de chaleur ou d'énergie de l'environnement pour répondre à ce besoin énergétique..
Et comment ces expressions sont-elles interprétées? Dans une réaction chimique, les liaisons sont toujours rompues pour en créer de nouvelles. Pour les briser, l'absorption d'énergie est nécessaire; c'est-à-dire qu'il s'agit d'une étape endothermique. Pendant ce temps, la formation des liaisons implique la stabilité, c'est donc une étape exothermique..
Lorsque les liaisons formées n'offrent pas une stabilité comparable à la quantité d'énergie nécessaire pour rompre les anciennes liaisons, il s'agit d'une réaction endothermique. C'est pourquoi une énergie supplémentaire est nécessaire pour favoriser la rupture des liaisons les plus stables dans les réactifs..
Par contre, dans les réactions exothermiques, c'est l'inverse qui se produit: de la chaleur est libérée et ΔH est < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Ils rafraîchissent leur environnement
Bien qu'elle ne s'applique pas à toutes les réactions endothermiques, plusieurs d'entre elles provoquent une diminution de la température de leur environnement. C'est parce que la chaleur absorbée vient de quelque part. Par conséquent, si la conversion de A et B était effectuée à l'intérieur d'un conteneur, il serait refroidi.
Plus la réaction est endothermique, plus le récipient et son environnement deviendront froids. En fait, certaines réactions sont même capables de former une fine couche de glace, comme si elles étaient sorties d'un réfrigérateur..
Cependant, il existe des réactions de ce type qui ne refroidissent pas leur environnement. Parce que? Parce que la chaleur environnante est insuffisante; c'est-à-dire qu'il ne fournit pas le Q (J, cal) nécessaire qui est écrit dans les équations chimiques. C'est donc à ce moment que le feu ou les rayons ultraviolets pénètrent..
Une petite confusion peut surgir entre les deux scénarios. D'une part, la chaleur de l'environnement est suffisante pour que la réaction se déroule spontanément et un refroidissement est observé; et d'autre part, il faut plus de chaleur et une méthode de chauffage efficace est utilisée. Dans les deux cas, la même chose se produit: l'énergie est absorbée.
Équations
Quelles sont les équations pertinentes dans une réaction endothermique? Comme déjà expliqué, le ΔH doit être positif. Pour le calculer, l'équation chimique suivante est d'abord considérée:
aA + bB => cC + dD
Où A et B sont les réactifs, et C et D sont les produits. Les lettres minuscules (a, b, c et d) sont les coefficients stoechiométriques. Pour calculer le ΔH de cette réaction générique, l'expression mathématique suivante est appliquée:
ΔHproduits- ΔHRéactifs = ΔHrxn
Vous pouvez procéder directement ou effectuer les calculs séparément. Pour ΔHproduits la somme suivante doit être calculée:
c ΔHFC + d ΔHFré
Où ΔHF est l'enthalpie de formation de chaque substance impliquée dans la réaction. Par convention, les substances sous leurs formes les plus stables ont ΔHF= 0. Par exemple, les molécules d'Odeux et Hdeux, ou un métal solide, ont ΔHF= 0.
Le même calcul est fait maintenant pour les réactifs, ΔHRéactifs:
un ΔHFA + b ΔHFB
Mais puisque l'équation dit que ΔHRéactifs doit être soustrait de ΔHproduits, alors la somme ci-dessus doit être multipliée par -1. Donc vous avez:
c ΔHFC + d ΔHFD - (un ΔHFA + b ΔHFB)
Si le résultat de ce calcul est un nombre positif, il s'agit d'une réaction endothermique. Et s'il est négatif, c'est une réaction exothermique.
Exemples de réactions endothermiques courantes
Évaporation de la glace sèche

Quiconque a déjà vu ces vapeurs blanches émanant d'un chariot de crème glacée a été témoin de l'un des exemples les plus courants de «réaction» endothermique.
Au-delà de certaines glaces, ces vapeurs dégagées par les solides blancs, appelées glace sèche, ont également fait partie des scénarios pour créer l'effet de brouillard. Cette glace sèche n'est rien de plus que du dioxyde de carbone solide, qui lors de l'absorption de la température et avant que la pression externe ne commence à se sublimer.
Une expérience pour un public d'enfants serait de remplir et de sceller un sac avec de la glace sèche. Après un certain temps, il finira par gonfler à cause du COdeux gazeux, qui génère du travail ou presse les parois internes du sac contre la pression atmosphérique.
Cuisson du pain ou cuisson des aliments

La cuisson du pain est un exemple de réaction chimique, car il y a maintenant des changements chimiques dus à la chaleur. Quiconque a senti l'arôme des pains fraîchement cuits sait qu'une réaction endothermique se produit.
La pâte et tous ses ingrédients ont besoin de la chaleur du four pour effectuer toutes les transformations, indispensables pour devenir pain et présenter ses caractéristiques typiques..
En plus des pains, la cuisine regorge d'exemples de réactions endothermiques. Celui qui cuisine les traite au quotidien. Cuire les pâtes, ramollir les grains, chauffer les grains de maïs, cuire les œufs, assaisonner les viandes, cuire un gâteau, faire du thé, réchauffer les sandwichs; chacune de ces activités sont des réactions endothermiques.
Bain de soleil

Aussi simples et courants qu'ils puissent paraître, les bains de soleil pris par certains reptiles, comme les tortues et les crocodiles, entrent dans la catégorie des réactions endothermiques. Les tortues absorbent la chaleur du soleil pour réguler leur température corporelle.
Sans le soleil, ils retiennent la chaleur de l'eau pour se réchauffer; qui aboutit au refroidissement de l'eau de vos étangs ou aquariums.
Réaction de l'azote atmosphérique et de la formation d'ozone

L'air est principalement composé d'azote et d'oxygène. Pendant les orages électriques, une telle énergie est libérée qu'elle peut rompre les liaisons fortes qui maintiennent les atomes d'azote ensemble dans la molécule N.deux:
Ndeux + OU ALORSdeux + Q => 2 NON
D'un autre côté, l'oxygène peut absorber le rayonnement ultraviolet pour devenir de l'ozone; allotrope d'oxygène très bénéfique dans la stratosphère, mais préjudiciable à la vie au niveau du sol. La réaction est:
3Odeux + v => 2O3
Où v signifie rayonnement ultraviolet. Le mécanisme derrière cette équation simple est très complexe.
Electrolyse de l'eau
L'électrolyse utilise l'énergie électrique pour séparer une molécule en ses éléments ou molécules de formation. Par exemple, dans l'électrolyse de l'eau, deux gaz sont générés: l'hydrogène et l'oxygène, chacun dans des électrodes différentes:
2HdeuxO => 2Hdeux + OU ALORSdeux
En outre, le chlorure de sodium peut subir cette même réaction:
2NaCl => 2Na + Cldeux
Dans une électrode, vous verrez la formation de sodium métallique, et dans l'autre, des bulles verdâtres de chlore.
Photosynthèse

Les plantes et les arbres ont besoin d'absorber la lumière du soleil comme source d'énergie pour synthétiser leurs biomatériaux. Pour cela, il utilise le CO comme matière première.deux et l'eau, qui, par une longue série d'étapes, est convertie en glucose et autres sucres. De plus, de l'oxygène se forme, qui est libéré par les feuilles.
Solutions de certains sels
Si le chlorure de sodium est dissous dans l'eau, il n'y aura pas de changement notable de la température extérieure du verre ou du récipient..
Certains sels, tels que le chlorure de calcium, CaCldeux, augmenter la température de l'eau en tant que produit de la grande hydratation des ions Cadeux+. Et d'autres sels, tels que le nitrate ou le chlorure d'ammonium, NH4NE PAS3 et NH4Cl, diminuer la température de l'eau et refroidir son environnement.
Dans les salles de classe, les expériences à domicile sont généralement effectuées en dissolvant certains de ces sels pour démontrer ce qu'est une réaction endothermique..
La baisse de température est due à l'hydratation des ions NH4+ il n'est pas favorisé contre la dissolution des arrangements cristallins de ses sels. Par conséquent, les sels absorbent la chaleur de l'eau pour permettre aux ions d'être solvatés..
Une autre réaction chimique qui est généralement très courante pour démontrer cela est la suivante:
Ba (OH)deux8HdeuxO + 2NH4NE PAS3 => Ba (NON3)deux + 2NH3 +10HdeuxOU ALORS
Notez la quantité d'eau formée. En mélangeant les deux solides, une solution aqueuse de Ba (NO3)deux, odeur d'ammoniaque, et avec une baisse de température telle qu'elle gèle littéralement la surface extérieure du récipient.
Décompositions thermiques
L'une des décompositions thermiques les plus courantes est celle du bicarbonate de sodium, NaHCO3, produire du COdeux et de l'eau lorsqu'elle est chauffée. De nombreux solides, y compris les carbonates, se décomposent souvent pour libérer du COdeux et l'oxyde correspondant. Par exemple, la décomposition du carbonate de calcium est la suivante:
Voleur3 + Q => CaO + COdeux
La même chose se produit avec les carbonates de magnésium, de strontium et de baryum.
Il est important de noter que la décomposition thermique est différente de la combustion. Dans le premier, il n'y a pas de présence d'inflammation ou de dégagement de chaleur, tandis que dans le second il y en a; c'est-à-dire que la combustion est une réaction exothermique, même lorsqu'elle a besoin d'une source de chaleur initiale pour se produire ou se produire spontanément.
Chlorure d'ammonium dans l'eau
Lorsqu'une petite quantité de chlorure d'ammonium (NH4Cl) est dissoute dans l'eau dans un tube à essai, le tube devient plus froid qu'auparavant. Au cours de cette réaction chimique, la chaleur est absorbée par l'environnement.
Triosulfate de sodium
Lorsque les cristaux de thiosulfate de sodium (NadeuxSdeuxOU ALORS3.5HdeuxO), communément appelé hoquet, se dissout dans l'eau, un effet de refroidissement se produit.
Moteurs de voiture
La combustion d'essence ou de diesel dans les moteurs de voitures, camions, tracteurs ou bus produit de l'énergie mécanique, qui est utilisée dans la circulation de ces véhicules.
Liquides bouillants
En mettant un liquide à chauffer, il gagne de l'énergie et passe à l'état gazeux.
Faire cuire un œuf
Lorsque la chaleur est appliquée, les protéines de l'œuf sont dénaturées, formant la structure solide qui est généralement ingérée..
Cuisiner
En général, toujours lors de la cuisson avec de la chaleur pour modifier les propriétés des aliments, des réactions endothermiques se produisent.
Ces réactions sont à l'origine de l'adoucissement des aliments, de la création de masses malléables, de la libération des composants qu'ils contiennent, entre autres..
Chauffer les aliments au micro-ondes
Par rayonnement micro-ondes, les molécules d'eau présentes dans les aliments absorbent de l'énergie, commencent à vibrer et augmentent la température des aliments.
Moulage de verre
L'absorption de chaleur par le verre rend ses joints flexibles, facilitant le changement de forme.
Consommation d'une bougie
La cire de bougie fond en absorbant la chaleur de la flamme, changeant sa forme.
Nettoyage à l'eau chaude
Lorsque vous utilisez de l'eau chaude pour nettoyer des objets tachés de graisse, tels que des casseroles ou des vêtements, la graisse devient plus liquide et est plus facile à éliminer.
Stérilisation à la chaleur des aliments et autres objets
Lors du chauffage d'objets ou d'aliments, les micro-organismes qu'ils contiennent augmentent également leur température.
Lorsqu'une grande quantité de chaleur est fournie, des réactions au sein des cellules microbiennes se produisent. Beaucoup de ces réactions, comme la rupture des liaisons ou la dénaturation des protéines, finissent par tuer les microorganismes.
Combattre les infections avec de la fièvre
Lorsqu'une fièvre survient, c'est parce que le corps produit la chaleur nécessaire pour tuer les bactéries et les virus qui causent des infections et génèrent des maladies..
Si la chaleur générée est importante et que la fièvre est élevée, les cellules du corps sont également touchées et il y a un risque de mort.
Évaporation de l'eau
Lorsque l'eau s'évapore et se transforme en vapeur, cela est dû à la chaleur qu'elle reçoit de l'environnement. Au fur et à mesure que l'énergie thermique est reçue par chaque molécule d'eau, son énergie de vibration augmente au point où elle peut se déplacer librement, créant de la vapeur..
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2018). Processus endothermique. Récupéré de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27 décembre 2018). Exemples de réactions endothermiques. Récupéré de: thinkco.com
- Khan Academy. (2019). Endothermique vs. réactions exothermiques. Récupéré de: khanacademy.org
- Serm Murmson. (2019). Que se passe-t-il au niveau moléculaire lors d'une réaction endothermique? Hearst Seattle Media. Récupéré de: education.seattlepi.com
- QuimiTube. (2013). Calcul de l'enthalpie de réaction à partir des enthalpies de formation. Récupéré de: quimitube.com
- Quimicas.net (2018). Exemples de réaction endothermique. Rétabli:
chemistry.net.



Personne n'a encore commenté ce post.