
Réaction endothermique et exothermique

Ongle réaction endothermique nécessite de l'énergie alors qu'un réaction exothermique libère de l'énergie. Cette classification des réactions chimiques prend en compte la participation de l'énergie soit en tant que réactif, soit en tant que produit..
L'énergie est la capacité de travailler ou de produire de la chaleur. Rappelez-vous que les réactions chimiques impliquent une réorganisation des atomes entre des substances avec rupture ou formation de liaisons chimiques. En général, cette formation ou rupture de liaisons chimiques s'accompagne de changements dans l'énergie du système..
| Réaction endothermique | Réaction exothermique | |
|---|---|---|
| Définition | Réaction chimique où l'énergie est absorbée. | Réaction chimique où de l'énergie est libérée sous forme de chaleur. |
| Origine de l'énergie | De l'environnement | Du système |
| Énergie potentielle | Moins de réactifs que de produits. | Plus grand dans les réactifs que dans les produits. |
| Production | Pas spontané | Spontané |
| Changement d'énergie interne | ΔE> 0; changement d'énergie interne supérieur à zéro. | ΔE<0; cambio de energía interna menor que cero. |
| Température | Diminue | Augmente |
| Exemples | Réactions de la photosynthèse et de la synthèse en général. | Une allumette brûlante, des réactions de combustion. |
Qu'est-ce qu'une réaction endothermique?
Une réaction chimique est endothermique lorsque absorbe l'énergie de l'environnement. Dans ce cas, la chaleur est transférée de l'extérieur vers l'intérieur du système. Lorsque nous plaçons un thermomètre pendant la réaction endothermique, la température diminue.
Le mot «endothermique» vient du grec endon qui signifie "à l'intérieur" et therme qui signifie «chaleur». Les réactions endothermiques ne se produisent pas spontanément.
D'où vient l'énergie dans les réactions endothermiques?
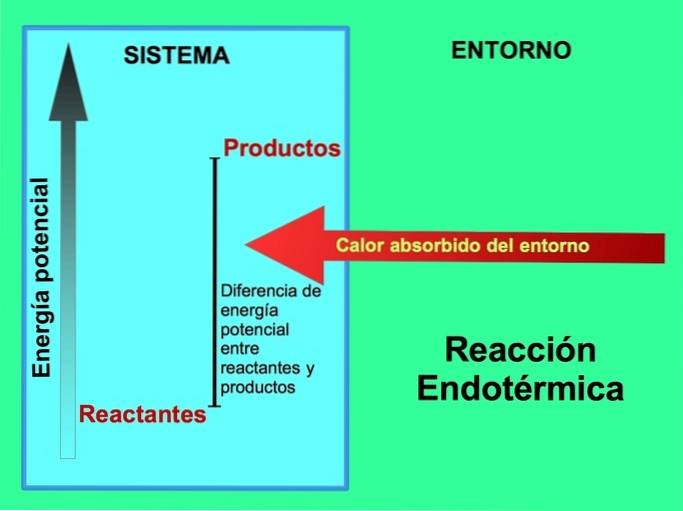
Dans les réactions endothermiques, l'énergie provient de l'environnement extérieur au système. La quantité d'énergie potentielle des produits est supérieure à l'énergie potentielle des réactifs. Par conséquent, il est nécessaire d'ajouter de l'énergie aux réactifs pour que la réaction se déroule. Cette énergie provient de la chaleur de l'environnement.
Par exemple, la photosynthèse est un processus endothermique, où les plantes captent l'énergie solaire pour produire du glucose à partir de dioxyde de carbone et d'oxygène:

Les produits de la réaction de photosynthèse, le glucose et l'oxygène, ont une plus grande quantité d'énergie potentielle par rapport aux réactifs, au dioxyde de carbone et à l'eau. Autres exemples de réactions chimiques endothermiques avec la quantité d'énergie utilisée:

Exemples de réaction endothermique
Ce n'est pas seulement dans le laboratoire de chimie que les réactions se produisent. Au jour le jour, nous trouvons également des situations où des réactions endothermiques se produisent.
Cuisiner
Bien que cela puisse ne pas en avoir l'air, le processus de cuisson des aliments est endothermique. Afin de consommer certains aliments, il faut fournir de la chaleur.
Sac froid instantané
Les compresses froides utilisées pour traiter les bosses ou les entorses sont remplies d'eau, mais lorsqu'elles sont secouées ou heurtées, une capsule contenant du nitrate d'ammonium se brise à l'intérieur. Le mélange de nitrate d'ammonium avec de l'eau est une réaction endothermique, provoquant le refroidissement du sac.
Qu'est-ce qu'une réaction exothermique?
Ongle la réaction exothermique est celle où l'énergie s'écoule hors du système. Cette énergie est libérée sous forme de chaleur, donc placer un thermomètre dans le système de réaction augmente la température.
Le mot «exothermique» est formé par exo qui signifie "vers l'extérieur" et thermes, qui signifie «chaleur». Des réactions exothermiques peuvent se produire spontanément et, dans certains cas, être explosives, comme la combinaison de métaux alcalins et d'eau.
D'où vient l'énergie dans les réactions exothermiques?
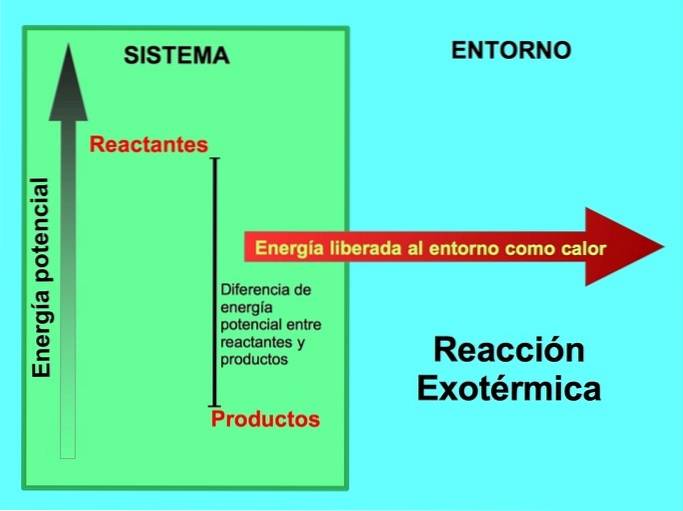
Dans une réaction chimique, les réactifs sont les composés qui se transforment et donnent naissance à des produits. Par exemple, lorsque le sodium Na réagit avec le chlore Cl, ce sont les réactifs et le produit est le chlorure de sodium NaCl:
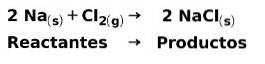
Les réactifs et les produits ont stocké de l'énergie potentielle. Nous savons de la lconservation de l'énergie ey que l'énergie n'est ni perdue ni gagnée, donc l'énergie des réactifs doit être égale à celle des produits.
Dans une réaction exothermique, lles réactifs ont plus d'énergie potentielle que les produits, donc l'énergie excédentaire est libérée sous forme de chaleur. Dans ce cas, l'énergie est également considérée comme faisant partie des produits:

Dans tout processus exothermique, une partie de l'énergie potentielle stockée dans les liaisons chimiques est convertie en énergie thermique par la chaleur..
Exemples de réaction exothermique
Lessive
Lorsque nous dissolvons un peu de lessive avec de l'eau dans nos mains, nous pouvons sentir un léger échauffement.
Combustion de gaz domestique
La combustion de gaz à usage domestique, comme le méthane ou le butane, implique la réaction chimique avec l'oxygène avec la formation de dioxyde de carbone et d'eau, et la libération d'énergie. Il s'agit d'une réaction exothermique typique en usage quotidien:
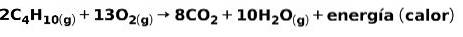
L'énergie libérée lors du processus de combustion est utilisée pour cuire les aliments.
Vous voudrez peut-être aussi savoir ce que sont un système ouvert, un système fermé et un système isolé.



Personne n'a encore commenté ce post.