
Caractéristiques des solutions tampons, préparation, exemples

le solutions tampons ou les tampons sont ceux qui peuvent diminuer les changements de pH dus aux ions H3OU ALORS+ et OH-. En l'absence de ceux-ci, certains systèmes (tels que les systèmes physiologiques) sont endommagés, car leurs composants sont très sensibles aux changements soudains de pH.
Tout comme les amortisseurs dans les voitures réduisent l'impact causé par leur mouvement, les tampons font de même mais avec l'acidité ou la basicité de la solution. De plus, les tampons établissent une plage de pH spécifique dans laquelle ils sont efficaces..

Sinon, les ions H3OU ALORS+ ils acidifieront la solution (le pH descend à des valeurs inférieures à 6), entraînant en conséquence une éventuelle altération du rendement de la réaction. Le même exemple peut être appliqué pour les valeurs de pH basiques, c'est-à-dire supérieures à 7.
Index des articles
- 1 Fonctionnalités
- 1.1 Composition
- 1.2 Ils neutralisent à la fois les acides et les bases
- 1.3 Efficacité
- 2 Préparation
- 3 exemples
- 4 Références
Caractéristiques
Composition
Ils sont essentiellement composés d'un acide (HA) ou d'une base faible (B), et de sels de leur base ou acide conjuguée. Par conséquent, il existe deux types: les tampons acides et les tampons alcalins..
Les tampons acides correspondent à la paire HA / A-, où aller- est la base conjuguée de l'acide faible HA et interagit avec des ions - tels que Na+- pour former des sels de sodium. De cette façon, la paire reste sous forme de HA / NaA, bien qu'ils puissent également être des sels de potassium ou de calcium.
Dérivé de l'acide faible HA, il tamponne les plages de pH acides (moins de 7) selon l'équation suivante:
HA + OH- => A- + HdeuxOU ALORS
Cependant, étant un acide faible, sa base conjuguée est partiellement hydrolysée pour régénérer une partie de l'AH consommé:
À- + HdeuxOU ALORS <=> HA + OH-
D'autre part, les tampons alcalins sont constitués de la paire B / HB+, où HB+ c'est l'acide conjugué de la base faible. Généralement, HB+ forme des sels avec des ions chlorure, laissant la paire sous forme de B / HBCl. Ces tampons tamponnent les plages de pH basiques (supérieures à 7):
B + H3OU ALORS+ => HB+ + HdeuxOU ALORS
Et encore une fois, HB+ peut être partiellement hydrolysé pour régénérer une partie de B consommé:
HB+ + HdeuxOU ALORS <=> B + H3OU ALORS+
Ils neutralisent à la fois les acides et les bases
Alors que les tampons acides tamponnent le pH acide et les tampons alcalins pH basique, les deux peuvent réagir avec les ions H.3OU ALORS+ et OH- à travers ces séries d'équations chimiques:
À- + H3OU ALORS+ => HA + HdeuxOU ALORS
HB+ + Oh- => B + HdeuxOU ALORS
Ainsi, dans le cas du couple HA / A-, HA réagit avec les ions OH-, tandis que A- -sa base conjuguée réagit avec le H3OU ALORS+. Concernant la paire B / HB+, B réagit avec les ions H3OU ALORS+, tandis que HB+ -son acide conjugué - avec l'OH-.
Cela permet aux deux tampons de neutraliser à la fois les espèces acides et basiques. Le résultat de ce qui précède par rapport, par exemple, à l'addition constante de moles d'OH-, est la diminution de la variation de pH (ΔpH):
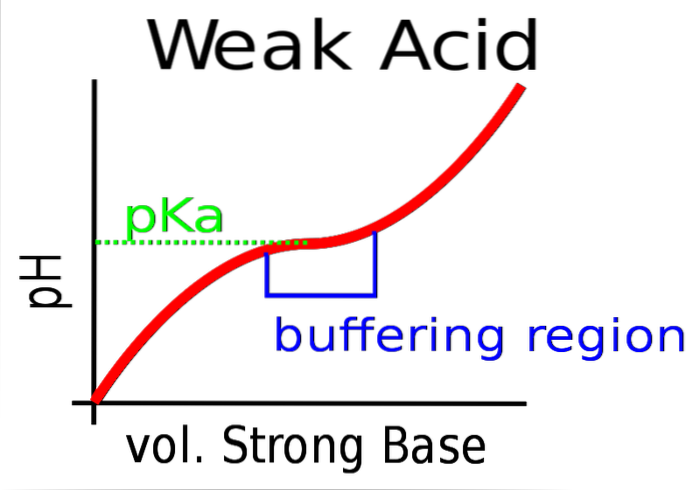
L'image du haut montre la mise en tampon du pH contre une base forte (donneur d'OH-).
Au départ, le pH est acide en raison de la présence de HA. Lorsque la base forte est ajoutée, les premières moles de A se forment- et le tampon commence à prendre effet.
Cependant, il y a une zone de la courbe où la pente est moins raide; c'est-à-dire là où l'amortissement est plus efficace (boîte bleuâtre).
Efficacité
Il existe plusieurs façons de comprendre le concept d'efficacité d'amortissement. L'une d'elles consiste à déterminer la deuxième dérivée de la courbe pH en fonction du volume de base, en résolvant V pour la valeur minimale, qui est Veq / 2.
Veq est le volume au point d'équivalence; c'est le volume de base nécessaire pour neutraliser tout l'acide.
Une autre façon de le comprendre est à travers la célèbre équation de Henderson-Hasselbalch:
pH = pKà + journal ([B] / [A])
Ici B désigne la base, A l'acide et pKà est le plus petit logarithme de la constante d'acidité. Cette équation s'applique à la fois à l'espèce acide HA et à l'acide conjugué HB+.
Si [A] est très grand par rapport à [B], le log () prend une valeur très négative, qui est soustraite du pKà. Si, par contre, [A] est très petit par rapport à [B], la valeur de log () prend une valeur très positive, qui est ajoutée à pKà. Cependant, lorsque [A] = [B], le log () est égal à 0 et le pH = pKà.
Que signifie tout ce qui précède? Que le ΔpH sera plus grand dans les extrêmes considérés pour l'équation, alors qu'il sera minimum avec un pH égal au pKà; et comme le pKà est caractéristique de chaque acide, cette valeur détermine la gamme pKà± 1.
Les valeurs de pH comprises dans cette plage sont celles dans lesquelles le tampon est le plus efficace..
préparation
Pour préparer une solution tampon, vous devez garder à l'esprit les étapes suivantes:
- Connaître le pH requis et, par conséquent, celui que vous souhaitez maintenir le plus constant possible pendant la réaction ou le processus.
- Connaissant le pH, on cherche tous les acides faibles, ceux dont le pKà est plus proche de cette valeur.
- Après avoir choisi l'espèce HA et calculé la concentration du tampon (en fonction de la quantité de base ou d'acide à neutraliser), la quantité nécessaire de son sel de sodium est pesée..
Exemples
L'acide acétique a un pKà de 4,75, CH3COOH; par conséquent, un mélange de certaines quantités de cet acide et d'acétate de sodium, CH3COONa, forme un tampon qui tamponne efficacement dans la plage de pH (3,75-5,75).
D'autres exemples d'acides monoprotiques sont les acides benzoïques (C6H5COOH) et formique (HCOOH). Pour chacun de ces leurs valeurs pKà ils sont 4,18 et 3,68; par conséquent, leurs gammes de pH tampons les plus élevées sont (3,18-5,18) et (2,68-4,68).
D'autre part, les acides polyprotiques tels que les acides phosphoriques (H3PO4) et carbonique (HdeuxCO3) ont autant de valeurs pKà car les protons peuvent se libérer. Ainsi, le H3PO4 a trois pKà (2.12, 7.21 et 12.67) et le HdeuxCO3 en a deux (6 352 et 10 329).
Si vous souhaitez maintenir un pH de 3 dans une solution, vous pouvez choisir entre HCOONa / HCOOH (pKà= 3,68) et NaHdeuxPO4/ H3PO4 (paquetà= 2,12).
Le premier tampon, celui de l'acide formique, est plus proche de pH 3 que le tampon d'acide phosphorique; donc les tampons HCOONa / HCOOH sont meilleurs à pH 3 que NaHdeuxPO4/ H3PO4.
Les références
- Day, R., et Underwood, A. Chimie analytique quantitative (cinquième éd.). Salle des Prentices PEARSON, p 188-194.
- Avsar Aras. (20 avril 2013). Mini amortisseurs. Extrait le 9 mai 2018 de: commons.wikimedia.org
- Wikipédia. (2018). Solution tampon. Extrait le 9 mai 2018 de: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, PhD. [Doc.]. Solutions tampons. Université médicale de Varna.
- Collectif Chem. Tutoriels Buffer. Extrait le 9 mai 2018 de: chemcollective.org
- askIITians. (2018). Solution tampon. Récupéré le 9 mai 2018 de: askiitians.com
- Quimicas.net (2018). Exemples de solutions tampons, tampons ou tampons. Récupéré le 9 mai 2018 de: quimicas.net


Personne n'a encore commenté ce post.