
Formules, utilisations, risques du sulfure de sodium
le sulfure de sodium (Na2S) est un solide cristallin jaune à rouge brique. Dans la nature, on le trouve à différents degrés d'hydratation, le plus courant étant le sulfure de sodium nonahydraté (Na2S 9H2O).
Ce sont des sels solubles dans l'eau qui donnent des solutions fortement alcalines. Lorsqu'ils sont exposés à l'air humide, ils absorbent l'humidité de l'air, pouvant se réchauffer spontanément et provoquer l'inflammation des matériaux combustibles à proximité. De même, au contact de l'air humide, ils émettent du sulfure d'hydrogène, qui sent les œufs pourris..

Ce sont de puissants agents réducteurs. Ces substances peuvent être dangereuses pour l'environnement, en particulier pour les organismes aquatiques.
Le monosulfure de sodium est fourni dans le commerce sous forme de flocons contenant 60 à 62% de NadeuxS ...
- Formules

- CAS: 1313-82-2 Sulfure de sodium (anhydre)
- CAS: 1313-84-4 Sulfure de sodium (nonahydraté)
Structure 2D
Structure 3D

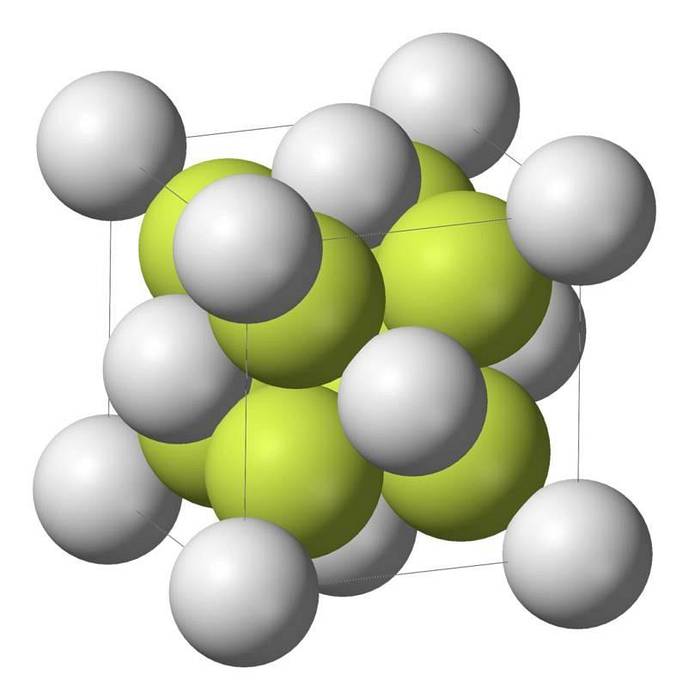
Caractéristiques du sulfure de sodium
Proprietes physiques et chimiques

Le monosulfure de sodium (Na2S) cristallise avec la structure antifluorite, dans laquelle chaque atome S est entouré d'un cube de 8 atomes de Na et chaque atome de Na par un tétraèdre à 4 atomes de S..
Inflammabilité
Le seul élément hautement inflammable du groupe sulfure inorganique est le sulfure d'hydrogène. Cependant, certains autres sulfures inorganiques, tels que le sulfure de sodium, peuvent s'échauffer spontanément et même s'enflammer s'ils sont exposés à l'humidité..
Lorsqu'il est exposé au feu, le sulfure de sodium libère des gaz ou des vapeurs de dioxyde de soufre, qui sont irritants ou toxiques.
Réactivité
- Les sulfures inorganiques sont généralement basiques (certains sont fortement basiques, et donc incompatibles avec les acides).
- Beaucoup de ces composés sont des agents réducteurs (ils réagissent vigoureusement avec les agents oxydants).
- Les sels de sulfure simples (tels que le sulfure de sodium, de potassium et d'ammonium) réagissent vigoureusement avec les acides pour libérer du sulfure d'hydrogène gazeux hautement toxique et inflammable..
- Le sulfure de sodium est inflammable. Peut exploser lorsqu'il est chauffé rapidement ou touché.
- Lorsqu'il est chauffé jusqu'à décomposition, il émet des fumées toxiques d'oxyde de sodium et d'oxydes de soufre.
- Réagit violemment avec le carbone, le charbon de bois, les sels de diazonium, la N, N-dichlorométhylamine, les oxydants forts et l'eau.
Toxicité
De nombreux membres du groupe des sulfures inorganiques se comportent comme des bases fortes et peuvent provoquer de graves brûlures au contact de la peau..
Cette propriété dépend de sa solubilité. Les sulfures inorganiques les plus insolubles (par exemple, le sulfure de mercure (II) et le sulfure de cadmium) ne sont pas caustiques.
Le sulfure de sodium a un coefficient de partage octanol / eau moyen (Pow) (de -3,5). Cette valeur est utilisée comme mesure de la solubilité (et de la bioconcentration) d'une substance dans les tissus adipeux des animaux (en particulier les animaux aquatiques)..
Le sulfure de sodium est considéré comme dangereux pour l'environnement, en particulier pour les organismes aquatiques.
Applications
À la maison, le sulfure de sodium est utilisé dans les nettoyeurs de drains, les nettoyants ménagers (pour le four, la salle de bain), les lisseurs de cheveux, le savon pour lave-vaisselle et les sacs gonflables pour automobiles..
Dans l'industrie, il est utilisé dans les nettoyants, dans le ciment et comme précurseur dans la production d'autres produits chimiques.
Effets cliniques
L'exposition au sulfure de sodium est courante dans les pays développés et sous-développés, à la fois dans l'industrie et à la maison. Ces substances corrosives sont présentes dans divers produits ménagers à de faibles concentrations..
Dans les pays développés, les effets graves sont rares. Ceux-ci se produisent principalement à la suite de l'ingestion délibérée du produit chimique chez les adultes. Cependant, dans les pays en développement, les effets graves sont plus fréquents.
Les corrosifs alcalins provoquent une nécrose de liquéfaction. Ils saponifient les graisses de la membrane cellulaire, détruisent la cellule et permettent une pénétration profonde dans le tissu muqueux.
Exposition orale
L'inflammation initiale se produit dans le tissu gastro-intestinal, suivie d'une nécrose tissulaire (avec perforation possible), puis d'une granulation et enfin d'une sténose..
Les patients avec une ingestion légère développent une irritation ou des brûlures de grade I (hyperémie superficielle et œdème) de l'oropharynx, de l'œsophage ou de l'estomac..
Les patients présentant une intoxication modérée peuvent développer des brûlures de grade II (cloques superficielles, érosions et ulcérations) avec éventuellement une formation de sténose (en particulier œsophagienne)..
Certains patients (en particulier les jeunes enfants) peuvent développer un œdème des voies respiratoires supérieures.
Les patients présentant une intoxication sévère par ingestion peuvent développer des brûlures profondes et une nécrose de la muqueuse gastro-intestinale, avec des complications telles que: perforation (œsophagienne, gastrique, rarement duodénale), formation de fistules (trachéo-œsophagien, aorto-œsophagien) et hémorragie gastro-intestinale..
Peut se développer: hypotension, tachycardie, tachypnée, formation de sténoses (principalement de l'œsophage), carcinome de l'œsophage et œdème des voies respiratoires supérieures (qui est fréquent et souvent mortel).
L'intoxication sévère est généralement limitée à des ingestions délibérées chez les adultes.
Exposition par inhalation
Une exposition légère peut provoquer une toux et un bronchospasme.
Une inhalation sévère peut provoquer un œdème des voies respiratoires supérieures, des brûlures, un stridor et, rarement, des lésions pulmonaires aiguës..
Exposition oculaire
Il peut provoquer une irritation conjonctivale sévère et une chimiose, des anomalies épithéliales cornéennes, une ischémie limbique, une perte visuelle permanente et dans les cas graves de perforation..
Exposition cutanée
Une exposition légère provoque une irritation et des brûlures d'épaisseur partielle. Une acidose métabolique peut se développer chez les patients souffrant de brûlures graves ou de choc..
Une exposition prolongée ou des produits à haute concentration peuvent provoquer des brûlures de pleine épaisseur.
Sécurité et risques
Mentions de danger du Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH)
Le Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH) est un système internationalement reconnu, créé par les Nations Unies et conçu pour remplacer les diverses normes de classification et d'étiquetage utilisées dans différents pays en utilisant des critères cohérents à l'échelle mondiale..
Les classes de danger (et leur chapitre GHS correspondant), les normes de classification et d'étiquetage et les recommandations pour le sulfure de sodium sont les suivantes (Agence européenne des produits chimiques, 2017; Nations Unies, 2015; PubChem, 2017):







Les références
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [image] Récupéré de: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Récupéré de: chem.nlm.nih.gov.
- ChemIDplus, (2017). Structure 3D de 1313-82-2 - Sulfure de sodium [image] Récupéré de: chem.nlm.nih.gov.
- ChemIDplus, (2017). Structure 3D de 1313-84-4 - Sulfure de sodium [image] Récupéré de: chem.nlm.nih.gov.
- Agence européenne des produits chimiques (ECHA). (2017). Résumé de la classification et de l'étiquetage.
- Classification harmonisée - Annexe VI du règlement (CE) n ° 1272/2008 (règlement CLP). Sulfure de sodium. Extrait le 16 janvier 2017 de: echa.europa.eu.
- Agence européenne des produits chimiques (ECHA). (2017). Résumé de la classification et de l'étiquetage.
- Classification et étiquetage notifiés. Sulfure de sodium, hydraté. Extrait le 16 janvier 2017 de: echa.europa.eu.
- Banque de données sur les substances dangereuses (HSDB). TOXNET. (2017). Sulfure de sodium. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: toxnet.nlm.nih.gov.
- Lange, L. et Triebel, W. (2000). Sulfures, polysulfures et sulfates. Dans l'Encyclopédie d'Ullmann de chimie industrielle. Wiley-VCH Verlag GmbH & Co. KGaA. Récupéré de dx.doi.org.
- Nations Unies (2015). Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH), sixième édition révisée. New York, UE: Publication des Nations Unies. Récupéré de: unece.org.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2016). Sulfure de sodium ennéhydraté - Structure de PubChem [image] Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2017). Monosulfure de sodium. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Centre national d'information sur la biotechnologie. Base de données des composés PubChem. (2017). Sulfure de sodium ennéhydraté. Bethesda, MD, UE: Bibliothèque nationale de médecine. Récupéré de: pubchem.ncbi.nlm.nih.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique chimique. Sulfure de sodium anhydre. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique du groupe réactif. Sulfures, inorganiques. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Récupéré de: wikipedia.org.
- PubChem, (2016). Monosulfure de sodium [image] Récupéré de: puchem.nlm.nih.gov.
- PubChem, (2016). Sulfure de sodium ennéhydraté [image] Récupéré de: puchem.nlm.nih.gov.
- Wikipédia. (2017). Coefficient de partage octanol-eau. Extrait le 17 janvier 2017 de: wikipedia.org.
- .


Personne n'a encore commenté ce post.