
Structure, propriétés, utilisations du tétrachlorure de carbone (CCl4)
le le tétrachlorure de carbone c'est un liquide incolore, avec une odeur légèrement sucrée, semblable à l'odeur de l'éther et du chloroforme. Sa formule chimique est CCl4, et il constitue un composé covalent et volatil, dont la vapeur est de plus grande densité que l'air; ce n'est pas un conducteur d'électricité ni inflammable.
On le trouve dans l'atmosphère, l'eau des rivières, la mer et les sédiments à la surface marine. On pense que le tétrachlorure de carbone présent dans les algues rouges est synthétisé par le même organisme.
Dans l'atmosphère, il est produit par la réaction du chlore et du méthane. Le tétrachlorure de carbone produit industriellement pénètre dans l'océan, principalement par l'interface mer-air. Son débit atmosphérique => océanique a été estimé à 1,4 x 10dix g / an, équivalent à 30% du tétrachlorure de carbone total dans l'atmosphère.
Index des articles
- 1 Principales caractéristiques
- 2 Structure
- 3 Propriétés physiques et chimiques
- 4 utilisations
- 4.1 Fabrication de produits chimiques
- 4.2 Fabrication de réfrigérants
- 4.3 Suppression des incendies
- 4.4 Nettoyage
- 4.5 Analyse chimique
- 4.6 Spectroscopie infrarouge et résonance magnétique nucléaire
- 4.7 Solvant
- 4.8 Autres utilisations
- 5 Toxicité
- 5.1 Mécanismes hépatotoxiques
- 5.2 Effets toxiques sur les systèmes rénal et nerveux central
- 5.3 Effets de l'exposition chez l'homme
- 5.4 Interactions toxiques
- 6 Interactions intermoléculaires
- 7 Références
Caractéristiques principales
Le tétrachlorure de carbone est produit industriellement par chloration thermique du méthane, faisant réagir le méthane avec du chlore gazeux à une température comprise entre 400 ° C et 430 ° C. Au cours de la réaction, un produit brut est généré, avec un sous-produit d'acide chlorhydrique.
Il est également produit industriellement par la méthode au bisulfure de carbone. Le chlore et le disulfure de carbone sont mis à réagir à une température de 90 ° C à 100 ° C, en utilisant du fer comme catalyseur. Ensuite, le produit brut est soumis à un fractionnement, une neutralisation et une distillation.
Le CCl4 Il a eu de multiples usages, entre autres: solvant pour graisses, huiles, vernis, etc.; nettoyage à sec de vêtements; Fumigation de pesticides, agricoles et fongicides et fabrication de nylon. Cependant, malgré sa grande utilité, son utilisation a été partiellement écartée en raison de la forte toxicité qu'elle présente..
Chez l'homme, il produit des effets toxiques sur la peau, les yeux et les voies respiratoires. Mais ses effets les plus néfastes se produisent sur le fonctionnement du système nerveux central, du foie et des reins. Les lésions rénales sont peut-être la principale cause de décès attribuable à l'action toxique du tétrachlorure de carbone.
Structure
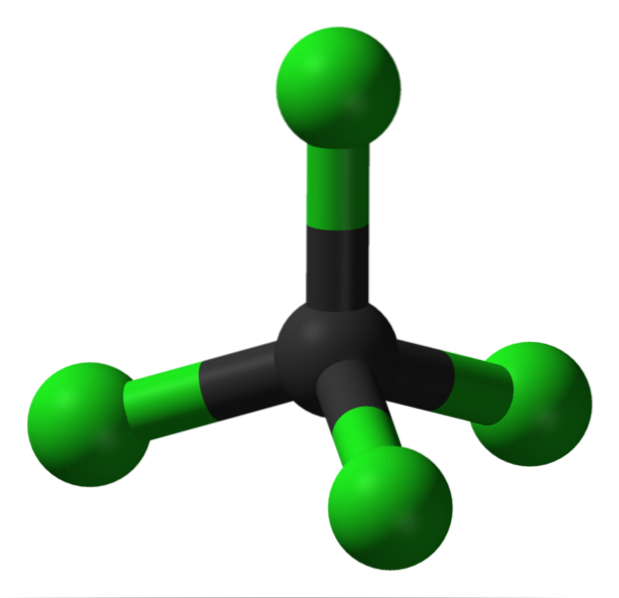
Dans l'image, vous pouvez voir la structure du tétrachlorure de carbone, qui est de géométrie tétraédrique. Notez que les atomes Cl (les sphères vertes) sont orientés dans l'espace autour du carbone (sphère noire) dessinant un tétraèdre.
De même, il faut mentionner que puisque tous les sommets du tétraèdre sont identiques, la structure est symétrique; c'est-à-dire quelle que soit la rotation de la molécule CCl4, ce sera toujours la même chose. Donc, puisque le tétraèdre vert de CCl4 est symétrique, il en résulte l'absence de moment dipolaire permanent.
Parce que? Parce que bien que les liaisons C-Cl soient de caractère polaire en raison de la plus grande électronégativité de Cl par rapport à C, ces moments s'annulent vectorly. Par conséquent, il s'agit d'un composé organique chloré apolaire..
Le carbone est entièrement chloré en CCl4, ce qui équivaut à une oxydation élevée (le carbone peut former un maximum de quatre liaisons avec le chlore). Ce solvant n'a pas tendance à perdre des électrons, est aprotique (ne contient pas d'hydrogène) et représente un petit moyen de transport et de stockage du chlore..
Proprietes physiques et chimiques
Formule
CCl4
Poids moléculaire
153,81 g / mol.
Aspect physique
C'est un liquide incolore. Cristallise sous forme de cristaux monocliniques.
Odeur
Il a l'odeur caractéristique présente dans d'autres solvants chlorés. L'odeur est aromatique et quelque peu sucrée, semblable à l'odeur du tétrachloroéthylène et du chloroforme.
Point d'ébullition
170,1 ° F (76,8 ° C) à 760 mmHg.
Point de fusion
-9 ° F (-23 ° C).
Solubilité dans l'eau
Il est peu soluble dans l'eau: 1,16 mg / mL à 25 ºC et 0,8 mg / mL à 20 ºC. Parce que? Parce que l'eau, une molécule hautement polaire, ne «ressent» pas d'affinité pour le tétrachlorure de carbone, qui est non polaire..
Solubilité dans les solvants organiques
En raison de la symétrie de sa structure moléculaire, le tétrachlorure de carbone est un composé non polaire. Par conséquent, il est miscible avec l'alcool, le benzène, le chloroforme, l'éther, le disulfure de carbone, l'éther de pétrole et le naphta. De même, il est soluble dans l'éthanol et l'acétone..
Densité
À l'état liquide: 1,59 g / ml à 68 º F et 1,594 g / ml à 20 ºC.
À l'état solide: 1,831 g / ml à -186 ºC et 1,809 g / ml à -80 ºC.
Stabilité
Généralement inerte.
Action corrosive
Attaque certaines formes de plastiques, caoutchoucs et revêtements.
point d'allumage
Il est considéré comme faiblement inflammable, indiquant que le point d'allumage est inférieur à 982 ºC.
Allumage automatique
982 ºC (1 800 º F; 1255 K).
Densité de vapeur
5,32 par rapport à l'air, pris comme valeur de référence égale à 1.
La pression de vapeur
91 mmHg à 68 ° F; 113 mmHg à 77 ° F et 115 mmHg à 25 ° C.
Décomposition
En présence d'incendie, il forme du chlorure et du phosgène, un composé hautement toxique. De même, dans les mêmes conditions, il se décompose en chlorure d'hydrogène et monoxyde de carbone. En présence d'eau à haute température, il peut provoquer de l'acide chlorhydrique.
Viscosité
2,03 x 10-3 Pa s
Seuil d'odeur
21,4 ppm.
Indice de réfraction (ηD)
1,4607.
Applications
Fabrication chimique
-Il intervient comme agent de chloration et / ou solvant dans la fabrication du chlore organique. De même, il intervient en tant que monomère dans la fabrication du Nylon..
-Agit comme solvant dans la fabrication de ciment de caoutchouc, de savon et d'insecticide.
-Il est utilisé dans la fabrication du propulseur chlorofluorocarbone.
-Comme il ne possède pas de liaisons C-H, le tétrachlorure de carbone ne subit pas de réactions radicalaires, ce qui en fait un solvant utile pour les halogénations, soit par un halogène élémentaire, soit par un réactif d'halogénation, tel que le N-bromosuccinimide..
Fabrication de réfrigérants
Il a été utilisé dans la production de chlorofluorocarbone, de réfrigérant R-11 et de trichlorofluorométhane, de réfrigérant R-12. Ces frigorigènes détruisent la couche d'ozone, c'est pourquoi il a été recommandé de cesser leur utilisation, conformément aux recommandations du Protocole de Montréal..
Suppression des incendies
Au début du 20e siècle, le tétrachlorure de carbone a commencé à être utilisé comme extincteur, sur la base d'un ensemble de propriétés du composé: il est volatil; sa vapeur est plus lourde que l'air; ce n'est pas un conducteur électrique et n'est pas très inflammable.
Lorsque le tétrachlorure de carbone est chauffé, il se transforme en une vapeur lourde qui recouvre les produits de combustion, les isolant de l'oxygène présent dans l'air et provoquant l'extinction du feu. Il convient à la lutte contre les incendies d'huile et d'appareils.
Cependant, à des températures supérieures à 500 ° C, le tétrachlorure de carbone peut réagir avec l'eau, provoquant le phosgène, un composé toxique, il faut donc faire attention à la ventilation pendant l'utilisation. De plus, il peut réagir de manière explosive avec le sodium métallique, et son utilisation dans les incendies avec la présence de ce métal doit être évitée..
Nettoyage
Le tétrachlorure de carbone est utilisé depuis longtemps dans le nettoyage à sec des vêtements et autres articles ménagers. De plus, il est utilisé comme dégraissant industriel pour métaux, excellent pour dissoudre la graisse et l'huile.
Analyse chimique
Utilisé pour la détection du bore, du bromure, du chlorure, du molybdène, du tungstène, du vanadium, du phosphore et de l'argent.
Spectroscopie infrarouge et résonance magnétique nucléaire
-Il est utilisé comme solvant en spectroscopie infrarouge, car le tétrachlorure de carbone n'a pas d'absorption significative dans les bandes> 1600 cm-1.
-Il était utilisé comme solvant en résonance magnétique nucléaire, car il n'interférait pas avec la technique car il ne contenait pas d'hydrogène (il est aprotique). Mais en raison de sa toxicité et de son faible pouvoir solvant, le tétrachlorure de carbone a été remplacé par des solvants deutérés..
Solvant
La caractéristique d'être un composé non polaire permet l'utilisation du tétrachlorure de carbone comme agent dissolvant pour les huiles, graisses, laques, vernis, cires de caoutchouc et résines. Il peut également dissoudre l'iode.
Autres utilisations
-C'est un composant important dans les lampes à lave, car le tétrachlorure de carbone ajoute du poids à la cire en raison de sa densité..
-Utilisé par les collectionneurs de timbres car il révèle des filigranes sur les timbres sans causer de dommages.
-Il a été utilisé comme agent pesticide et fongicide et dans la fumigation des céréales afin d'éliminer les insectes.
-Dans le processus de coupe du métal, il est utilisé comme lubrifiant.
-Il a été utilisé en médecine vétérinaire comme anthelminthique dans le traitement de la fasciolase causée par Fasciola hepatica chez le mouton..
Toxicité
-Le tétrachlorure de carbone peut être absorbé par les voies respiratoire, digestive, oculaire et cutanée. L'ingestion et l'inhalation sont très dangereuses car elles peuvent causer de graves dommages à long terme au cerveau, au foie et aux reins..
-Le contact avec la peau provoque une irritation et à long terme peut provoquer une dermatite. Alors que le contact avec les yeux provoque une irritation.
Mécanismes hépatotoxiques
Les principaux mécanismes qui produisent des lésions hépatiques sont le stress oxydatif et l'altération de l'homéostasie calcique.
Le stress oxydatif est un déséquilibre entre la production d'espèces réactives de l'oxygène et la capacité du corps à générer un environnement réducteur, au sein de ses cellules, qui contrôle les processus oxydatifs..
Le déséquilibre dans l'état redox normal peut provoquer des effets toxiques dus à la production de peroxydes et de radicaux libres qui endommagent tous les composants des cellules..
Le tétrachlorure de carbone est métabolisé en produisant des radicaux libres: Cl3C. (radical trichlorométhyle) et Cl3ROUCOULER. (radical peroxyde de trichlorométhyle). Ces radicaux libres produisent une lipoperoxydation, qui endommage le foie et les poumons.
Les radicaux libres provoquent également la dégradation de la membrane plasmique des cellules hépatiques. Cela produit une augmentation de la concentration de calcium cytosolique et une diminution du mécanisme intracellulaire de séquestration du calcium..
L'augmentation du calcium intracellulaire active l'enzyme phospholipase Adeux qui agit sur les phospholipides de la membrane, aggravant son affectation. De plus, il y a une infiltration de neutrophiles et une lésion hépatocellulaire. Il y a une diminution de la concentration cellulaire d'ATP et de glutathion qui provoque l'inactivation des enzymes et la mort cellulaire.
Effets toxiques sur le système rénal et le système nerveux central
Les effets toxiques du tétrachlorure de carbone se manifestent dans le système rénal avec une diminution de la production d'urine et de l'accumulation d'eau dans le corps. Surtout dans les poumons et une augmentation de la concentration de déchets métaboliques dans le sang. Cela peut causer la mort.
Au niveau du système nerveux central, il y a atteinte de la conduction axonale de l'influx nerveux.
Effets de l'exposition chez l'homme
Courte durée
Irritation de l'oeil; effets sur le foie, les reins et le système nerveux central, pouvant entraîner une perte de conscience.
Longue durée
Dermatite et action cancérigène possible.
Interactions toxiques
Il existe une association entre de nombreux cas d'intoxication au tétrachlorure de carbone et la consommation d'alcool. Une consommation excessive d'alcool provoque des lésions hépatiques, entraînant dans certains cas une cirrhose hépatique.
On a observé que la toxicité du tétrachlorure de carbone était augmentée avec les barbituriques, car ils ont des effets toxiques similaires..
Par exemple, au niveau rénal, les barbituriques réduisent l'excrétion urinaire, cette action des barbituriques étant similaire à l'effet toxique du tétrachlorure de carbone sur la fonction rénale..
Interactions intermoléculaires
Le CCl4 il peut être considéré comme un tétraèdre vert. Comment interagissez-vous avec les autres?
Étant une molécule apolaire, sans moment dipolaire permanent, elle ne peut pas interagir par des forces dipôle-dipôle. Pour maintenir leurs molécules ensemble dans le liquide, les atomes de chlore (les sommets des tétraèdres) doivent interagir les uns avec les autres d'une manière ou d'une autre; et ils le font grâce aux forces de dispersion de Londres.
Les nuages électroniques d'atomes de Cl se déplacent, et pendant de brefs instants, génèrent des zones riches et pauvres en électrons; c'est-à-dire qu'ils génèrent des dipôles instantanés.
La zone riche en électrons δ- provoque la polarisation de l'atome Cl d'une molécule voisine: Clδ- δ+Cl. Ainsi, deux atomes de Cl peuvent être maintenus ensemble pendant un temps limité..
Mais, comme il y a des millions de molécules CCl4, les interactions deviennent suffisamment efficaces pour former un liquide dans des conditions normales.
De plus, les quatre Cl liés de manière covalente à chaque C augmentent considérablement le nombre de ces interactions; à tel point qu'il bout à 76,8 ° C, un point d'ébullition élevé.
Le point d'ébullition de CCl4 il ne peut pas être plus élevé car les tétraèdres sont relativement petits par rapport à d'autres composés apolaires (comme le xylène, qui bout à 144 ° C).
Les références
- Hardinger A. Steven. (2017). Glossaire illustré de chimie organique: tétrachlorure de carbone. Récupéré de: chem.ucla.edu
- Tout Siyavula. (s.f.). Forces intermoléculaires et interatomiques. Récupéré de: siyavula.com
- Carey F. A. (2006). Chimie organique. (Sixième édition). Mc Graw Hill.
- Wikipédia. (2018). Le tétrachlorure de carbone. Récupéré de: en.wikipedia.org
- PubChem. (2018). Le tétrachlorure de carbone. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Livre chimique. (2017). Le tétrachlorure de carbone. Récupéré de: Chemicalbook.com
Personne n'a encore commenté ce post.