
Types de liaisons chimiques

Les liaisons chimiques sont les forces qui maintiennent les atomes ensemble pour former les molécules. Il existe trois types de liaisons entre les atomes:
- Lien métallique.
- Liaison ionique.
- Liaison covalente: non polaire, polaire, simple, double, triple, dative.
Grâce à ces liaisons, tous les composés qui existent dans la nature se forment. Il existe également des forces qui maintiennent les molécules ensemble, appelées liaisons intermoléculaires, telles que:
- Liaisons ou liaisons hydrogène.
- Forces dipôle-dipôle.
Ensuite, nous expliquons chacun de ces liens.
| Types de liaison chimique | Caractéristique | Exemples | |
|---|---|---|---|
| Métal | Les ions métalliques flottent dans une mer d'électrons en mouvement. | Éléments métalliques: sodium, baryum, argent, fer, cuivre. | |
| Ionique | Transfert d'électrons d'un atome à un autre. | Chlorure de sodium Na+Cl- | |
| Covalent | Non polaire | Partager les électrons de manière égale entre deux atomes. | Hydrogène moléculaire H-H ou Hdeux |
| Polaire | Partager les électrons de manière inégale entre deux atomes. | Molécule d'eau HdeuxOU ALORS | |
| Simple | Partagez une paire d'électrons. | Molécule de chlore Cldeux Cl-Cl | |
| Double | Partagez deux paires d'électrons. | Molécule d'oxygène Odeux O = O | |
| Tripler | Partagez trois paires d'électrons. | Molécule d'azote N≣N ou Ndeux | |
| Datif | Un seul des atomes partage les électrons. | Liaison entre l'azote et le bore dans le composé trifluorure d'ammoniaque et de bore. | |
| Forces intermoléculaires | Pont d'hydrogène | Les hydrogènes d'une molécule sont attirés par les atomes électronégatifs d'une autre molécule. | Liaisons hydrogène entre l'hydrogène d'une molécule d'eau et l'oxygène d'une autre molécule d'eau. |
| Dipôle-dipôle | Les molécules à deux pôles électriques attirent les pôles opposés d'autres molécules. | Interactions entre les molécules de méthanal HdeuxC = O | |
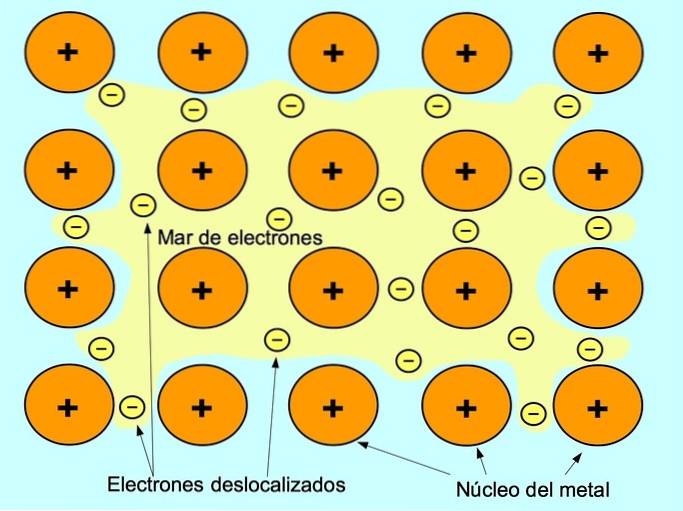
Lien métallique
La liaison métallique est la force d'attraction entre les ions positifs des éléments métalliques et les électrons négatifs qui se déplacent librement entre les ions. Les atomes métalliques sont étroitement emballés, cela permet aux électrons de se déplacer dans le réseau des atomes.
Dans les métaux, les électrons de valence sont libérés de leur atome d'origine et forment une «mer» d'électrons qui flotte autour de toute la structure métallique. Cela provoque la transformation des atomes métalliques en ions métalliques chargés positivement qui s'emballent..
La liaison métallique est établie entre des éléments métalliques tels que le sodium Na, le baryum Ba, le calcium Ca, le magnésium Mg, l'or Au, l'argent Ag et l'aluminium Al.
Liaison ionique
La liaison ionique est la force qui relie un élément métallique, tel que le sodium ou le magnésium, à un élément non métallique, tel que le chlore ou le soufre. Le métal perd des électrons et se transforme en un ion métallique positif appelé cation. Ces électrons passent à l'élément non métallique et se transforme en un ion chargé négativement appelé anion.
Les cations et les anions se combinent et forment un réseau tridimensionnel qui est maintenu par les forces d'attraction électrostatique entre les ions de charges différentes. Ces forces forment des composés ioniques.
La croûte terrestre est constituée principalement de composés ioniques. La plupart des roches, minéraux et pierres précieuses sont des composés ioniques. Par exemple:
- Chlorure de sodium NaCl: l'élément métallique est le sodium qui transfère un électron en chlore, qui est l'élément non métallique.
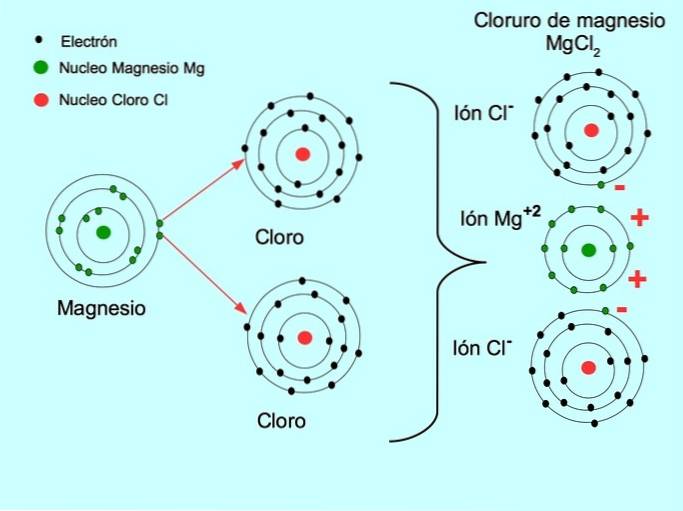
- Chlorure de magnésium MgCldeux: Le magnésium Mg donne deux électrons à deux atomes de chlore, comme le montre la figure ci-dessous:
Voir aussi Différence entre les cations et les anions.
Une liaison covalente
La liaison covalente se forme lorsque deux atomes non métalliques partagent des électrons. Cette liaison peut être de plusieurs types en fonction de l'affinité pour les électrons des atomes et de la quantité d'électrons partagés.
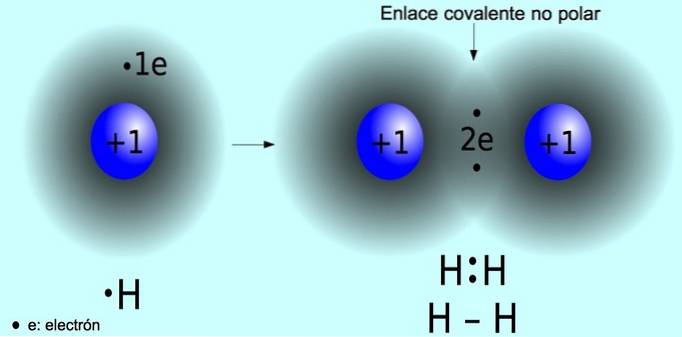
Liaison covalente non polaire
La liaison covalente non polaire est la liaison qui se forme entre deux atomes où les électrons sont partagés de manière égale. Cette liaison se produit normalement dans des molécules symétriques, c'est-à-dire des molécules composées de deux atomes égaux, comme la molécule d'hydrogène Hdeux et la molécule d'oxygène Odeux.
Liaison covalente polaire
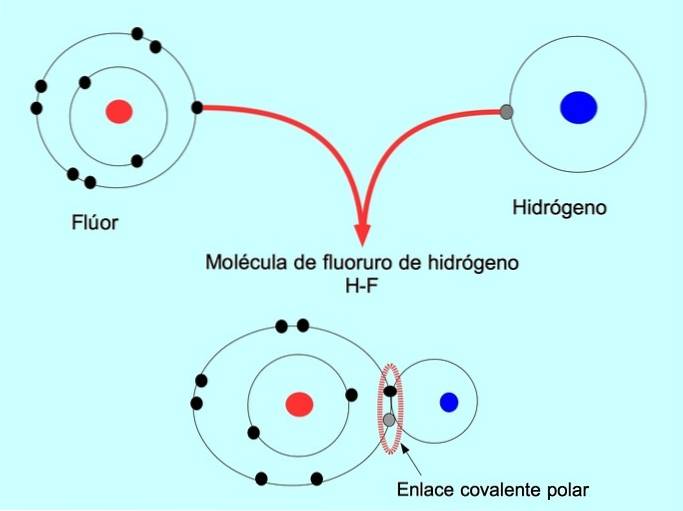
La liaison covalente polaire est formée lorsque deux atomes partagent des électrons, mais l'un d'eux a une plus grande attraction pour les électrons. Cela donne à la molécule un "pôle" plus négatif avec un plus grand nombre d'électrons et le pôle opposé est plus positif..
Les molécules avec cette distribution ou ce déséquilibre d'électrons sont appelées polaires. Par exemple, dans le fluorure d'hydrogène HF, il existe une liaison covalente entre l'hydrogène et le fluor, mais le fluor a une électronégativité plus élevée, de sorte qu'il attire plus fortement les électrons partagés..
Liaison covalente simple
Lorsque deux atomes partagent deux électrons, un de chacun, la liaison covalente formée s'appelle une simple liaison covalente.
Par exemple, le chlore est un atome qui a sept électrons de valence dans sa coquille externe, qui peut être remplie de huit électrons. Un chlore peut se combiner avec un autre chlore pour former la molécule de chlore Cldeux qui est beaucoup plus stable que le chlore seul.
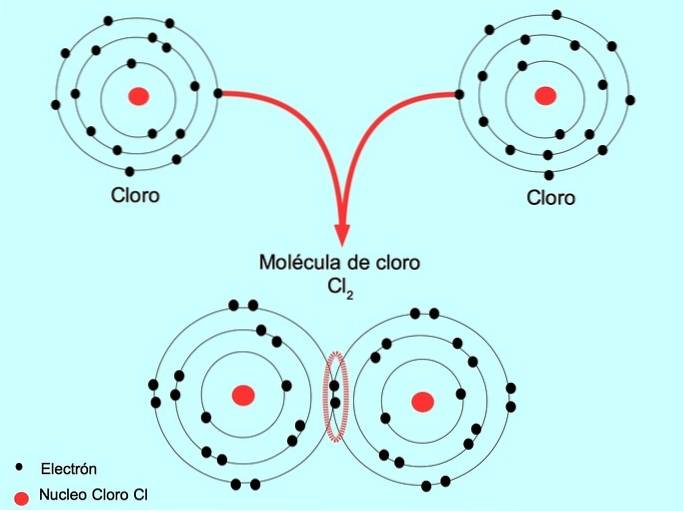
Double liaison covalente
La double liaison covalente est la liaison où quatre électrons (deux paires) d'électrons sont partagés entre deux atomes. Par exemple, l'oxygène a 6 électrons dans sa dernière coquille. Lorsque deux oxygènes sont combinés, quatre électrons sont partagés entre les deux, ce qui fait que chacun a 8 électrons dans la dernière coquille..
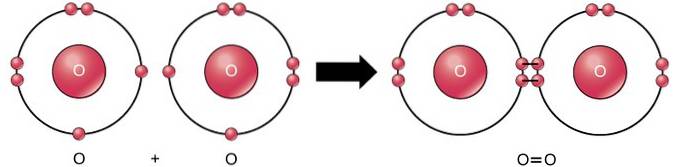
Triple liaison covalente
La triple liaison covalente est formée lorsque 6 électrons (ou trois paires) sont partagés entre deux atomes. Par exemple, dans la molécule de cyanure d'hydrogène HCN, une triple liaison est formée entre le carbone et l'azote, comme le montre la figure ci-dessous:
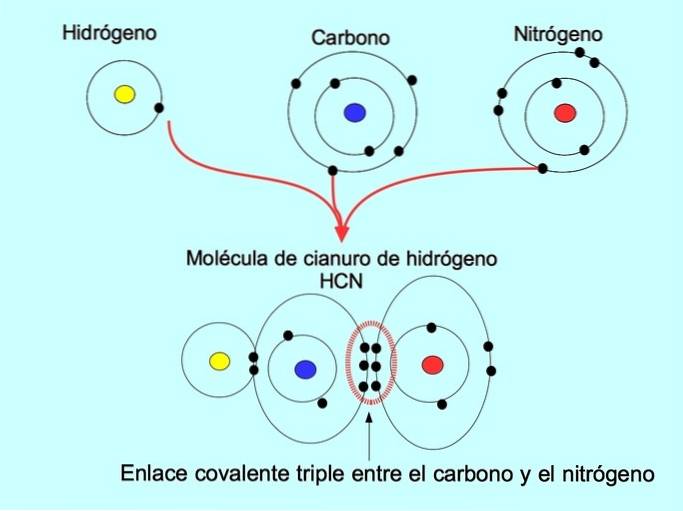
Liaison covalente coordonnée ou dative
La liaison covalente coordonnée ou dative est la liaison qui se forme lorsqu'un seul des atomes de la liaison apporte une paire d'électrons. Par exemple, lorsque l'ammoniac NH réagit3 avec trifluorure de bore BF3, L'azote se lie avec deux électrons directement au bore, qui n'a pas d'électrons disponibles à partager. De cette manière, l'azote et le bore sont laissés avec 8 électrons dans leur coquille de valence..
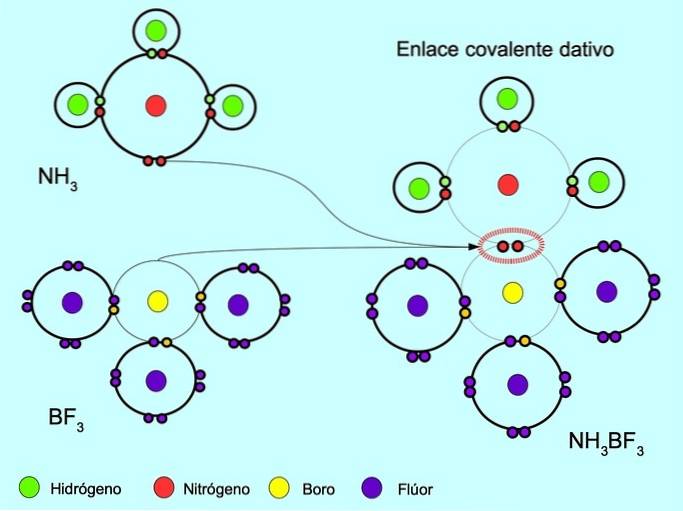
Voir aussi Composés organiques et inorganiques.
Liens intermoléculaires
Les molécules s'associent par des forces qui permettent de former des substances à l'état liquide ou solide.
Liaisons ou forces dipôle-dipôle
De faibles liaisons intermoléculaires peuvent être établies entre les molécules polaires lorsque les pôles négatifs sont attirés par les pôles positifs et vice versa. Par exemple, le méthanal HdeuxC = O est une molécule polaire, avec une charge partiellement négative sur l'oxygène et une charge positive partielle sur les hydrogènes. Le côté positif d'une molécule méthanale attire le côté négatif d'une autre molécule méthanale.
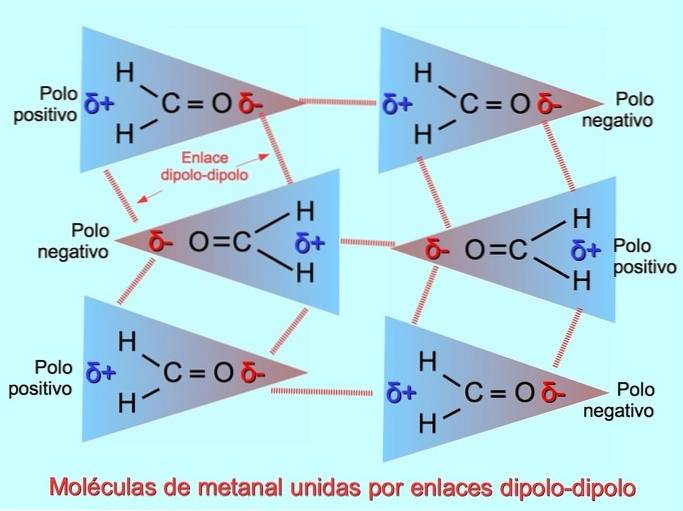
Liaisons ou liaisons hydrogène
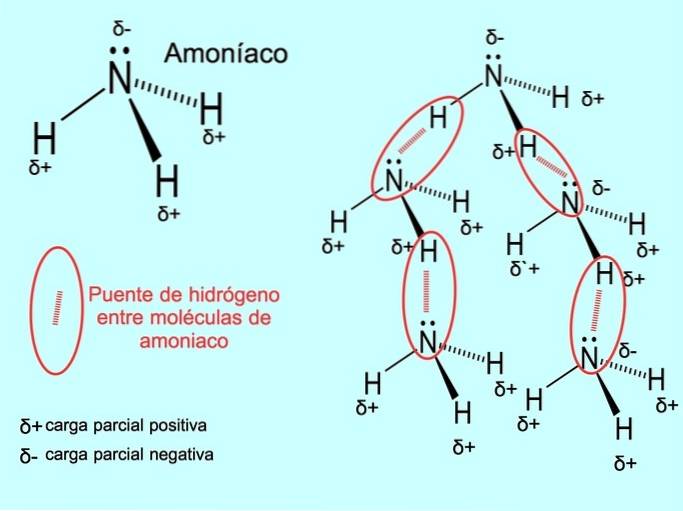
La liaison hydrogène ou liaison hydrogène est une liaison qui s'établit entre les molécules. Cela se produit lorsqu'un hydrogène dans la molécule est lié de manière covalente à un oxygène, un azote ou un fluor. L'oxygène, l'azote et le fluor sont des atomes avec une électronégativité plus élevée, ils attirent donc plus fortement les électrons lorsqu'ils les partagent avec un autre atome moins électronégatif..
Il existe des liaisons hydrogène entre les molécules d'eau HdeuxO et NH ammoniac3 comme le montre l'image:
Vous pourriez être intéressé à voir:
- Atomes et molécules.
- Exemples de composés organiques et inorganiques.
Les références
Zumdahl, S.S., Zumdahl, S.A. (2014) Chimie. Neuvième édition. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5e édition. Pearson Australie. Melbourne.



Personne n'a encore commenté ce post.