
Structure, propriétés, utilisations, risques de l'oxyde de baryum (BaO)

le oxyde de baryum C'est un solide inorganique formé par un atome de baryum (Ba) et un atome d'oxygène (O). Sa formule chimique est BaO. C'est un solide cristallin blanc et hygroscopique, c'est-à-dire qu'il absorbe l'humidité de l'air, mais ce faisant, il réagit avec lui..
La réaction rapide de l'oxyde de baryum avec l'eau le rend utilisé dans les laboratoires d'analyses chimiques pour sécher, c'est-à-dire éliminer l'eau des solvants organiques, qui sont des composés liquides qui servent à dissoudre d'autres substances..

Le BaO se comporte comme une base forte, il réagit donc avec de nombreux types d'acides. Par exemple, réagit facilement avec le dioxyde de carbone COdeux de l'air pour former du carbonate de baryum BaCO3.
Il est utilisé dans la fabrication de polymères pour les câbles d'alimentation et comme ingrédient pour les résines pour sceller les trous dans les dents qui ont été durcies..
L'oxyde de baryum (BaO) est également utilisé dans l'industrie de la céramique, à la fois pour l'enduire de glaçure et pour sa fabrication. Il est également utilisé dans les mélanges de ciment pour augmenter la résistance à la compression du produit final..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 Propriétés physiques
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Solubilité
- 4 Propriétés chimiques
- 5 risques
- 6 Obtention
- 7 utilisations
- 7.1 Comme déshydratant pour les solvants organiques
- 7.2 Dans les lampes à décharge
- 7.3 Dans la fabrication de céramiques
- 7.4 Lors de la préparation de mélanges de ciment
- 7.5 Dans diverses applications
- 8 Références
Structure
L'oxyde de baryum BaO est composé d'un cation Badeux+ et un anion oxygène Odeux-.
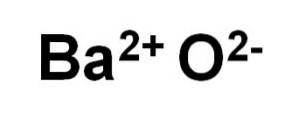
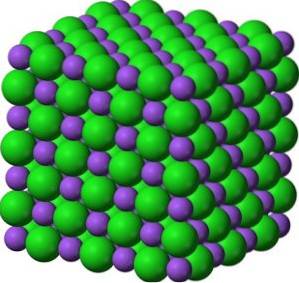
Dans ses cristaux, BaO forme des réseaux ioniques cubiques (en forme de cube) de type chlorure de sodium.
La configuration électronique de l'ion baryum est: [Xe] 6s0 car il a perdu les deux électrons de la coque 6s. Cette configuration est très stable.
Nomenclature
-Oxyde de baryum
-Monoxyde de baryum
Propriétés physiques
État physique
Solide cristallin blanc jaunâtre.
Poids moléculaire
153,33 g / mol
Point de fusion
1923 ºC
Point d'ébullition
Environ 2000 ºC.
Densité
5,72 g / cm3
Solubilité
Légèrement soluble dans l'eau: 3,8 g / 100 mL à 20 ºC.
Propriétés chimiques
L'oxyde de baryum BaO réagit rapidement avec l'eau, dégageant de la chaleur et formant une solution corrosive d'hydroxyde de baryum Ba (OH)deux, qui est l'hydroxyde le plus soluble parmi les hydroxydes de métaux alcalino-terreux.
BaO + HdeuxO → Ba (OH)deux
BaO est une base solide. Réagit de manière exothermique (c'est-à-dire avec dégagement de chaleur) avec tous les types d'acides.
Avec COdeux BaO réagit pour former du carbonate de baryum BaCO3.
BaO + COdeux → BaCO3
Le BaO est hygroscopique, donc s'il est laissé exposé à l'environnement, il se joint peu à peu à l'humidité de l'air, formant du Ba (OH)deux qui se combine avec le dioxyde de carbone COdeux de l'air pour donner du carbonate de baryum BaCO3.
Lorsque le monoxyde de baryum BaO est chauffé en présence d'air, il se combine avec l'oxygène pour former du peroxyde de baryum BaOdeux. La réaction est réversible.
2 BaO + Odeux ⇔ 2 BaOdeux
En présence d'eau, il peut réagir avec l'aluminium Al ou le zinc Zn, formant les oxydes ou hydroxydes desdits métaux et générant de l'hydrogène gazeux Hdeux.
Peut initier la polymérisation de composés organiques polymérisables, tels que les époxydes.
Des risques
Peut être toxique en cas d'ingestion. Il ne doit pas entrer en contact avec la peau. Il est irritant pour les yeux, la peau et les voies respiratoires. Cela peut être nocif pour le système nerveux. Il est capable de provoquer de faibles taux de potassium, entraînant des troubles cardiaques et musculaires.
Obtention
L'oxyde de baryum BaO peut être obtenu en chauffant le carbonate de baryum BaCO3 avec du charbon de bois. Du BaO se forme et du monoxyde de carbone CO est libéré.
Bacchus3 + C → BaO + 2 CO ↑
Applications
Comme déshydratant pour les solvants organiques
En raison de sa facilité de réaction avec l'eau, le BaO est utilisé depuis le milieu du siècle dernier comme déshydratant pour l'essence et les solvants organiques basiques ou neutres..
BaO est un séchage très actif autour de lui, il absorbe très rapidement l'humidité, avec un dégagement de chaleur assez important, formant de l'hydroxyde de baryum Ba (OH)deux qui est stable jusqu'à environ 1000 ºC. Pour cette raison, BaO peut être utilisé à des températures élevées..
Il a également une capacité d'absorption d'eau élevée. Pour chaque molécule de BaO, l'un de l'eau et le Ba (OH) peuvent être absorbésdeux résultant peut également absorber une certaine quantité d'eau.
Il convient aux laboratoires de chimie analytique. Pas collant.
Il peut être utilisé dans les dessiccateurs, qui sont de grands récipients en verre avec un couvercle où l'environnement interne est maintenu au sec. BaO maintient l'atmosphère miniature du dessiccateur au sec.

Ces dessiccateurs sont utilisés pour placer des substances ou des réactifs et ainsi les empêcher d'absorber l'eau de l'environnement.
Il est également utilisé pour sécher des gaz basiques tels que l'ammoniac NH.3.
Dans les lampes à décharge
BaO est placé sur les électrodes des lampes à décharge en tant que matériau émetteur d'électrons.
Les lampes à décharge sont constituées d'un tube de verre, de quartz ou d'un autre matériau approprié, elles contiennent un gaz inerte et dans la plupart des cas une vapeur métallique. La vapeur métallique peut être du sodium ou du mercure.

Des décharges électriques se produisent à l'intérieur du tube car il a une électrode positive et une électrode négative.
Le BaO est placé sur les électrodes de la lampe. Les électrons qu'il émet entrent en collision avec les atomes de la vapeur du métal et leur transmettent de l'énergie..
Lorsqu'un courant électrique traverse ce gaz ou cette vapeur, une lumière visible ou un rayonnement ultraviolet (UV) est produit..
Dans la fabrication de céramiques
BaO est utilisé dans les compositions de revêtement de glaçure céramique.

Cependant, il a également été testé comme additif dans la préparation de vitrocéramique.
BaO améliore efficacement les caractéristiques mécaniques et la résistance chimique de ce type de céramique. Il a une forte influence sur les propriétés thermiques et la composition de la phase cristalline des matériaux obtenus..
Dans la préparation de mélanges de ciment
BaO a été testé en tant que composant du ciment phosphoaluminé.
Ce type de ciment est utile dans les environnements marins, car il n'a pas la même tendance à s'hydrater que les autres types de ciment, il ne souffre donc pas de formation de pores ou d'expansion..
Cependant, les ciments phosphoaluminés doivent être renforcés dans leurs performances mécaniques afin de résister aux courants marins et aux coups de morceaux de glace flottants présents dans l'océan..
L'ajout de BaO au ciment phosphoaluminé modifie la structure minérale dudit matériau, améliore la structure des pores et augmente considérablement la résistance à la compression de la pâte de ciment..
En d'autres termes, BaO améliore la résistance à la compression de ce type de ciment..

Dans diverses applications
Il est utilisé comme ingrédient pour fournir l'opacité des résines dentaires pour le remplissage des trous dans les dents, effectué par les dentistes.
Il est également utilisé comme agent de nucléation pour la préparation de polymères de polyfluorure de vinylidène qui sont utilisés pour isoler les câbles d'alimentation..
Les références
- Partyka, J. et coll. (2016). Effet de l'ajout de BaO sur le frittage de matériaux vitrocéramiques à partir de SiOdeux-AudeuxOU ALORS3-N / AdeuxD'ACCORDdeuxSystème O-CaO / MgO. J Therm Anal Calorim (2016) 125: 1095. Récupéré de link.springer.com.
- Zhang, P. et coll. (2019). Effet du BaO sur la structure minérale et le comportement d'hydratation du ciment phosphoaluminé. J Therm Anal Calorim (2019) 136: 2319. Récupéré de link.springer.com.
- NOUS. Bibliothèque nationale de médecine. (2019). Oxyde de baryum. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Éclairage. Principe. Dans le livre de référence de l'ingénieur en électricité (seizième édition). Récupéré de sciencedirect.com.
- Ebnesajjad, S. (2003). Mousses de fluoropolymère. PVDF moussant. Dans les fluoroplastiques transformables en fusion. Récupéré de sciencedirect.com.
- Booth, H.S. et McIntyre, L.H. (1930). Oxyde de baryum comme dessicant. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Récupéré de pubs.acs.org.


Personne n'a encore commenté ce post.