
Structure, propriétés, utilisations, risques de l'oxyde de zinc (ZnO)

le oxyde de zinc C'est un composé inorganique dont la formule chimique est ZnO. Il se compose uniquement d'ions Zndeux+ jedeux- dans un rapport 1: 1; cependant, son réseau cristallin peut présenter une lacune de Odeux-, ce qui donne lieu à des défauts structurels susceptibles d'altérer les couleurs de vos cristaux synthétiques.
Il est acquis dans le commerce sous la forme d'un solide blanc poudreux (image du bas), qui est produit directement à partir de l'oxydation du zinc métallique par le procédé français; ou soumettre les minerais de zinc à une réduction carbothermique, de telle sorte que leurs vapeurs s'oxydent et finissent par se solidifier.

D'autres méthodes de préparation du ZnO consistent à précipiter son hydroxyde, le Zn (OH)deux, à partir de solutions aqueuses de sels de zinc. De même, des films minces ou nanoparticules de ZnO morphologiquement variés peuvent être synthétisés en utilisant des techniques plus sophistiquées telles que le dépôt chimique de ses vapeurs..
Cet oxyde métallique se trouve dans la nature sous forme de zincite minéral, dont les cristaux sont généralement jaunes ou oranges en raison d'impuretés métalliques. Les cristaux de ZnO sont caractérisés en ce qu'ils sont piézoélectriques, thermochromiques, luminescents, polaires et ont également une très large bande d'énergie dans leurs propriétés semi-conductrices..
Structurellement, il est isomorphe au sulfure de zinc, ZnS, adoptant des cristaux hexagonaux et cubiques similaires à ceux de la wurzite et de la blende, respectivement. Dans ceux-ci, il y a un certain caractère covalent dans les interactions entre Zndeux+ jedeux-, ce qui provoque une distribution hétérogène des charges dans le cristal de ZnO.
Les études sur les propriétés et les utilisations du ZnO s'étendent aux domaines de la physique, de l'électronique et de la biomédecine. Ses utilisations les plus simples et les plus quotidiennes passent inaperçues dans la composition des crèmes pour le visage et des produits d'hygiène personnelle, ainsi que dans les crèmes solaires.
Index des articles
- 1 Structure
- 1.1 Polymorphes
- 1.2 Interactions
- 1.3 Morphologie des nanoparticules
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Masse molaire
- 2.3 Point de fusion
- 2.4 Densité
- 2.5 Solubilité dans l'eau
- 2.6 Amphotéricisme
- 2.7 Capacité calorifique
- 2.8 Écart énergétique direct
- 3 utilisations
- 3.1 Médicinal
- 3.2 Antibactérien
- 3.3 Pigments et revêtements
- 3.4 Bioimages
- 3.5 Additif
- 3.6 Éliminateur de sulfure d'hydrogène
- 4 risques
- 5 Références
Structure
Polymorphes
Le ZnO cristallise dans des conditions normales de pression et de température dans une structure hexagonale de wurzite. Dans cette structure, les ions Zndeux+ jedeux- sont disposés en couches alternées, de manière à ce que chacun se retrouve entouré d'un tétraèdre, avec ZnO4 ou OZn4, respectivement.
De plus, en utilisant un "gabarit" ou un support cubique, le ZnO peut être amené à cristalliser en une structure cubique de blende de zinc; qui, comme la wurzite, correspondent à des structures isomorphes (identiques dans l'espace mais avec des ions différents) de sulfure de zinc, ZnS.
En plus de ces deux structures (wurzite et blende), le ZnO sous haute pression (environ 10 GPa) cristallise dans la structure du sel gemme, la même que celle du NaCl.
Les interactions
Interactions entre Zndeux+ jedeux- présentent un certain caractère de covalence, donc il y a partiellement une liaison covalente Zn-O (les deux atomes avec hybridation sp3), et en raison de la distorsion des tétraèdres, ils manifestent un moment dipolaire qui s'ajoute aux attractions ioniques des cristaux de ZnO.
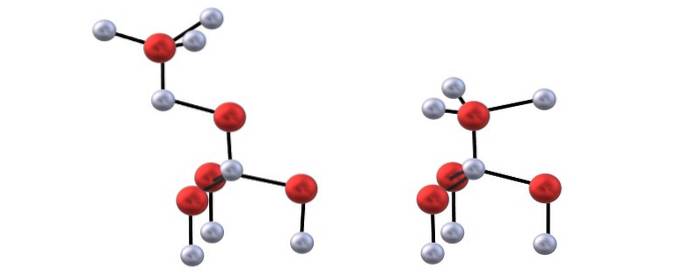
Vous avez l'image du haut pour visualiser les tétraèdres mentionnés pour les structures ZnO.
La différence entre les structures blenda et wurzite réside également dans le fait que vu de dessus, les ions ne sont pas éclipsés. Par exemple, dans la wurzite, on apprécie que les sphères blanches (Zndeux+) sont juste au-dessus des sphères rouges (Odeux-). Par contre, dans la structure cubique de blende cela ne se produit pas car il y a trois couches: A, B et C au lieu de seulement deux.
Morphologie des nanoparticules
Bien que les cristaux de ZnO aient tendance à avoir des structures wurzites hexagonales, la morphologie de leurs nanoparticules est une autre histoire. En fonction des paramètres et des méthodes de synthèse, ceux-ci peuvent prendre des formes aussi variées que des bâtonnets, des plaques, des feuilles, des sphères, des fleurs, des ceintures, des aiguilles, entre autres..
Propriétés
Apparence physique
Solide blanc, inodore, poudreux avec un goût amer. Dans la nature, il peut être trouvé cristallisé, avec des impuretés métalliques, telles que le minéral de zincite. Si ces cristaux sont blancs, ils présentent du thermochromisme, ce qui signifie que lorsqu'ils sont chauffés, ils changent de couleur: du blanc au jaune..
De même, ses cristaux synthétiques peuvent présenter des couleurs rougeâtres ou verdâtres en fonction de leur composition stoechiométrique en oxygène; c'est-à-dire les lacunes ou les lacunes causées par le manque d'anions Odeux- affecte directement la façon dont la lumière interagit avec les réseaux ioniques.
Masse molaire
81,406 g / mol
Point de fusion
1974 ° C A cette température, il subit une décomposition thermique libérant des vapeurs de zinc et de l'oxygène moléculaire ou gazeux..
Densité
5,1 g / cm3
Solubilité dans l'eau
Le ZnO est pratiquement insoluble dans l'eau, donnant à peine des solutions avec une concentration de 0,0004% à 18 ºC.
Amphotéricisme
Le ZnO peut réagir avec les acides et les bases. Lorsqu'il réagit avec un acide en solution aqueuse, sa solubilité augmente en formant un sel soluble où Zndeux+ finit par se complexer avec des molécules d'eau: [Zn (OHdeux)6]deux+. Par exemple, il réagit avec l'acide sulfurique pour produire du sulfate de zinc:
ZnO + HdeuxSW4 → ZnSO4 + HdeuxOU ALORS
De même, il réagit avec les acides gras pour former leurs sels respectifs, tels que le stéarate de zinc et le palmitate..
Et quand il réagit avec une base, en présence d'eau, les sels de zinc se forment:
ZnO + 2NaOH + HdeuxO → Nadeux[Zn (OH)4]
Capacité thermique
40,3 J / K mol
Écart énergétique direct
3,3 eV. Cette valeur en fait un semi-conducteur à large bande, capable de fonctionner sous des champs électriques intenses. Il présente également les caractéristiques d'être un semi-conducteur du type n, qui n'a pas pu expliquer les raisons pour lesquelles il y a une contribution supplémentaire d'électrons dans sa structure.
Cet oxyde se distingue par ses propriétés optiques, acoustiques et électroniques, grâce auxquelles il est considéré comme un candidat pour des applications potentielles liées au développement de dispositifs optoélectroniques (capteurs, diodes laser, cellules photovoltaïques). La raison de ces propriétés dépasse le domaine de la physique.
Applications
Médicinal
L'oxyde de zinc a été utilisé comme additif dans de nombreuses crèmes blanches pour le traitement des irritations, des acnés, des dermatites, des écorchures et des fissures de la peau. Dans ce domaine, son utilisation est populaire pour soulager les irritations causées par les couches sur la peau des bébés..
C'est également un composant des écrans solaires, car avec les nanoparticules de dioxyde de titane, TiOdeux, Il aide à bloquer les rayons ultraviolets du soleil, il agit également comme agent épaississant, c'est pourquoi on le retrouve dans certains maquillages légers, lotions, émaux, talcs et savons..
D'autre part, le ZnO est une source de zinc utilisé dans les compléments alimentaires et les produits vitaminés, ainsi que dans les céréales..
Antibactérien
Selon la morphologie de ses nanoparticules, le ZnO peut être activé sous rayonnement ultraviolet pour générer des peroxydes d'hydrogène ou des espèces réactives qui fragilisent les membranes cellulaires des microorganismes.
Lorsque cela se produit, les nanoparticules de ZnO restantes sillonnent le cytoplasme et commencent à interagir avec le recueil de biomolécules qui composent la cellule, entraînant leur apoptose..
C'est pourquoi toutes les nanoparticules ne peuvent pas être utilisées dans des compositions de protection solaire, mais uniquement celles qui n'ont pas d'activité antibactérienne..
Les produits contenant ce type de ZnO sont conçus, recouverts de matériaux polymères solubles, pour traiter les infections, les plaies, les ulcères, les bactéries et même le diabète..
Pigments et revêtements
Le pigment connu sous le nom de zinc blanc est le ZnO, qui est ajouté à diverses peintures et revêtements pour protéger les surfaces métalliques où ils sont appliqués de la corrosion. Par exemple, des revêtements avec du ZnO ajouté sont utilisés pour protéger le fer galvanisé..
D'autre part, ces revêtements ont également été utilisés sur des vitres pour empêcher la chaleur de pénétrer (si elle est à l'extérieur) ou d'entrer (si elle est à l'intérieur). De même, il protège certains matériaux polymères et textiles de la détérioration due à l'action du rayonnement solaire et de la chaleur..
Bioimages
La luminescence des nanoparticules de ZnO a été étudiée pour une utilisation en bioimagerie, étudiant ainsi les structures internes des cellules à travers les lumières bleues, vertes ou oranges qui rayonnent..
Additif
Le ZnO est également utilisé comme additif dans les caoutchoucs, les ciments, les matériaux de dentifrice, les verres et les céramiques, en raison de son point de fusion plus bas et, par conséquent, se comporte comme un fondant..
Éliminateur de sulfure d'hydrogène
ZnO élimine les gaz H désagréablesdeuxOui, aidant à désulfurer certaines fumées:
ZnO + HdeuxS → ZnS + HdeuxOU ALORS
Des risques
L'oxyde de zinc en tant que tel est un composé non toxique et inoffensif, de sorte que la manipulation prudente de son solide ne présente aucun risque..
Le problème, cependant, réside dans sa fumée, car si à haute température elle se décompose, les vapeurs de zinc finissent par contaminer les poumons et provoquer une sorte de «fièvre des métaux». Cette maladie se caractérise par des symptômes de toux, de fièvre, une sensation d'oppression dans la poitrine et un goût métallique constant dans la bouche..
Il n'est pas non plus cancérigène et les crèmes qui en contiennent n'ont pas démontré d'augmenter l'absorption du zinc dans la peau, de sorte que les écrans solaires à base de ZnO sont considérés comme sûrs; sauf en cas de réactions allergiques, auquel cas son utilisation doit être arrêtée.
Concernant certaines nanoparticules destinées à lutter contre les bactéries, celles-ci pourraient avoir des effets négatifs si elles ne sont pas transportées correctement vers leur site d'action..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Oxyde de zinc. Récupéré de: en.wikipedia.org
- Hadis Morkoç et Ümit Özgur. (2009). Oxyde de zinc: principes de base, matériaux et technologie des appareils. [PDF]. Récupéré de: application.wiley-vch.de
- Parihar, M. Raja et R. Paulose. (2018). Un bref examen des propriétés structurelles, électriques et électrochimiques des nanoparticules d'oxyde de zinc. [PDF]. Récupéré de: ipme.ru
- A. Rodnyi et I. V. Khodyuk. (2011). Propriétés optiques et de luminescence de l'oxyde de zinc. Récupéré de: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin et Husen, A. (2018). Propriétés des nanoparticules d'oxyde de zinc et de leur activité contre les microbes. Lettres de recherche à l'échelle nanométrique, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- ChemicalSafetyFacts. (2019). Oxyde de zinc. Récupéré de: Chemicalsafetyfacts.org
- Jinhuan Jiang, Jiang Pi et Jiye Cai. (2018). L'avancement des nanoparticules d'oxyde de zinc pour les applications biomédicales. Chimie bio-organique et applications, vol. 2018, numéro d'article 1062562, 18 pages. doi.org/10.1155/2018/1062562


Personne n'a encore commenté ce post.