
Histoire du benzène, structure, propriétés, dérivés, utilisations
le benzène C'est un composé organique qui se compose de l'un des hydrocarbures aromatiques les plus simples de tous. Sa formule chimique est C6H6, dont on sait que le rapport entre le carbone et l'hydrogène est égal à 1; c'est-à-dire que pour chaque carbone, il y a un hydrogène lié à celui-ci.
Bien que son aspect physique soit celui d'un liquide incolore, il se trouve naturellement dans le pétrole et les produits pétroliers. Son odeur est très caractéristique, car elle ressemble à un mélange de colle, de bitume et d'essence; par contre, c'est un liquide volatil et inflammable.

L'image ci-dessus montre un récipient ou une bouteille contenant du benzène, vraisemblablement d'une pureté non analytique. Si elles n'étaient pas couvertes, les vapeurs de benzène se répandraient immédiatement dans tout le laboratoire. Pour cette raison, ce liquide, couramment utilisé comme simple solvant, est manipulé à l'intérieur d'une hotte..
Être sa formule C6H6, les chimistes du 19e siècle ont proposé de nombreuses structures possibles qui correspondraient audit rapport C / H égal à 1. Non seulement cela, mais la molécule de benzène devait avoir des liaisons spéciales de telle sorte que sa stabilité inhabituelle contre les réactions d'addition pouvait être expliquée; typique pour les alcènes et les polyènes.
C'est ainsi que leurs liens représentaient une énigme pour les chimistes de l'époque; jusqu'à ce que la propriété soit appelée aromaticité. Avant considéré comme un hexacyclotriène (avec trois liaisons C = C), le benzène est bien plus que cela, et c'est un autre des nombreux exemples de synergie en chimie.
En chimie organique, le benzène est un symbole classique, la base structurelle de plusieurs composés polyaromatiques. Des dérivés sans fin sont obtenus à partir de son hexagone par substitution électrophile aromatique; un anneau à partir des bords duquel la structure qui définit de nouveaux composés est tissée.
En fait, ses dérivés sont dus aux vastes utilisations industrielles pour lesquelles ils ont besoin du benzène comme matière première. De la préparation des colles et des fibres textiles aux plastiques, caoutchoucs, pigments, drogues et explosifs. D'autre part, le benzène se trouve naturellement dans les volcans, les incendies de forêt, l'essence et la fumée de cigarette..
Index des articles
- 1 Histoire
- 1.1 Découverte et noms
- 1.2 Production industrielle
- 1.3 Structures historiques
- 2 Structure du benzène
- 2.1 Résonance
- 2.2 Cristaux
- 3 propriétés
- 3.1 Masse moléculaire
- 3.2 Apparence physique
- 3.3 Point d'ébullition
- 3.4 Point de fusion
- 3.5 Point d'éclair
- 3.6 Température d'auto-inflammation
- 3.7 Densité
- 3.8 Solubilité
- 3.9 Densité de vapeur
- 3.10 Pression de vapeur
- 3.11 Chaleur de combustion
- 3.12 Chaleur de vaporisation
- 3.13 tension superficielle
- 3.14 Indice de réfraction
- 4 Dérivés
- 5 utilisations
- 6 Nomenclature
- 7 Toxicité
- 8 Références
Histoire
Découverte et noms
Sa découverte remonte à 1825, généralement attribuée à Michael Faraday, lorsqu'il a collecté et fait des expériences avec un produit pétrolier restant du gaz utilisé pour l'éclairage. Ce liquide contenait un rapport C / H proche de 1, c'est pourquoi il l'a appelé `` hydrogène carburé ''.
Le chimiste Auguste Laurent a nommé l'étrange hydrocarbure `` phéno '', dérivé du mot grec ``phainein'qui signifie brillant (car il a été obtenu après la combustion du gaz). Cependant, ce nom n'a pas été accepté par la communauté scientifique et n'a prévalu que comme `` phényle '', pour désigner le radical dérivé du benzène.
À partir de la gomme de benjoin, le chimiste Eilhard Mitscherlich, neuf ans plus tard, a réussi à produire le même composé; Par conséquent, il y avait une autre source pour le même hydrocarbure, qu'il a baptisé «benzine». Cependant, ils n'ont pas non plus considéré le nom approprié, en supposant qu'il s'agissait d'un alcaloïde, tel que la quinine..
Ainsi, ils ont remplacé le nom «benzine» par «benzol». Cependant, là encore, il y avait des contradictions et des divergences du fait que le terme «benzol» confondait l'hydrocarbure avec un alcool. C'est alors que le nom de «benzène» est né, utilisé pour la première fois en France et en Angleterre..
Production industrielle
Ni le gaz d'éclairage ni la gomme de benjoin n'étaient des sources appropriées pour produire du benzène à grande échelle. Charles Mansfield, en collaboration avec August Wilhelm von Hofmann, réussit en 1845 à isoler le benzène (vingt ans après sa découverte) du goudron de houille, un produit secondaire de la production de coke..
C'est ainsi qu'a commencé la production industrielle de benzène à partir de goudron de houille. La disponibilité du benzène en quantités massives a facilité l'étude de ses propriétés chimiques et lui a permis d'être mis en relation avec d'autres composés présentant des réactivités similaires. August Wilhelm von Hofmann a lui-même inventé le mot `` aromatique '' pour le benzène et les composés apparentés.
Structures historiques
Le rêve d'August Kekulé
On attribue à Friedrich August Kekulé la structure hexagonale et cyclique du benzène vers 1865, issue d'un étrange rêve avec Uroboros, le serpent qui se mord la queue en dessinant un cercle. Ainsi, il pensait que le benzène pouvait être considéré comme un anneau hexagonal, et d'autres chimistes ont proposé des structures possibles, qui sont illustrées ci-dessous:

Certaines des structures supérieures pourraient expliquer la stabilité du benzène.
Livre, anneaux et prisme
A noter que la troisième structure n'est même pas un anneau mais un prisme triangulaire, proposé par Albert Ladenburg en 1869; à sa gauche, un en forme de livre ouvert, proposé par Sir James Dewar en 1867; et à sa droite, un avec tous les hydrogènes dirigés vers le centre de l'anneau, proposé par Henry Edward Armstrong en 1887.
La première structure, proposée par Adolf Karl Ludwig Claus en 1867, est également assez particulière, puisque les liaisons C-C sont croisées. Et la dernière était la bague "serpentine" de Kekulé, rêvée en 1865.
Quel était le «gagnant»? La cinquième structure (de gauche à droite), proposée en 1899 par Johannes Thiele.
Dans cette étude, l'hybride de résonance a été considéré pour la première fois, qui combinait les deux structures de Kekulé (tournez le premier anneau à droite pour l'observer) et expliquait extraordinairement la délocalisation des électrons et, avec elle, la stabilité jusqu'alors inhabituelle de le benzène.
Structure du benzène
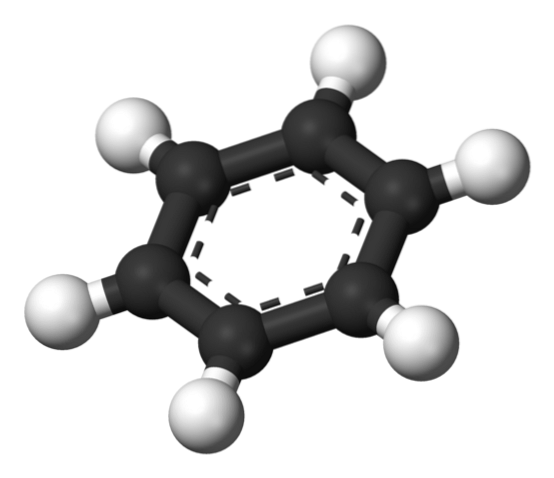
Ci-dessus, la structure proposée par Thiele utilisant un modèle de sphères et de barres..
La molécule de benzène est plate, les atomes d'hydrogène pointant vers l'extérieur depuis les côtés du cycle. Tous les atomes de carbone ont une hybridation spdeux, avec une orbitale p disponible pour établir le système aromatique dans lequel se délocalisent six électrons.
Ces carbones spdeux sont plus électronégatifs que les hydrogènes, et par conséquent, les premiers retirent la densité électronique aux seconds (Csp2δ--Hδ+). Par conséquent, le centre de l'anneau a une concentration d'électrons plus élevée que ses côtés..
Plus précisément, le système aromatique peut être représenté sous la forme d'un nuage ou d'un tampon électronique déployé de part et d'autre de l'anneau hexagonal; et au milieu, par les côtés ou les bords, une carence électronique constituée d'hydrogènes à charge partielle positive.
Grâce à cette répartition des charges électriques, les molécules de benzène peuvent interagir entre elles par des forces dipôle-dipôle; Atomes Hδ+ sont attirés par le centre olfactif d'un anneau voisin (cela sera illustré ci-dessous).
Aussi, les centres aromatiques peuvent être empilés les uns sur les autres pour favoriser l'induction des dipôles instantanés..
Résonance

Les deux structures de Kekulé sont représentées en haut de l'image, et en dessous, l'hybride de résonance. Comme les deux structures se produisent encore et encore en même temps, l'hybride est représenté par un cercle dessiné au milieu (semblable à celui d'un "beignet hexagonal").
Le cercle hybride est important car il indique le caractère aromatique du benzène (et celui de nombreux autres composés). De plus, il souligne que les liens ne sont pas aussi longs que C-C, ni aussi courts que C = C; mais la longueur du même est entre les deux extrêmes. Ainsi, le benzène n'est pas considéré comme un polyène.
Ce qui précède a été démontré en mesurant les longueurs des liaisons C-C (139 pm) du benzène, qui sont un peu plus allongées que les liaisons C-H (109 pm).
Cristaux
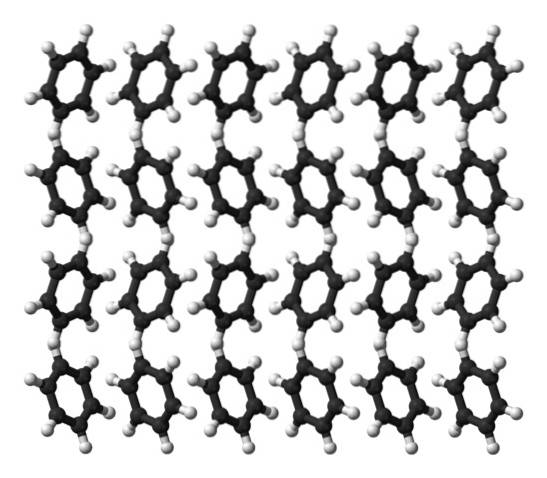
Le benzène est un liquide à température ambiante. Ses forces intermoléculaires signifient que, même s'il n'a pas un moment dipolaire aussi prononcé, il peut maintenir ses molécules ensemble dans un liquide qui bout à 80 ° C. Lorsque la température descend en dessous de 5 ° C, le benzène commence à geler: et ainsi ses cristaux correspondants sont obtenus..
Les anneaux de benzène peuvent adopter des modèles structurels définis dans leur solide. Leurs dipôles les font "basculer" vers la gauche ou vers la droite, formant des rangées susceptibles d'être reproduites par une cellule élémentaire orthorhombique. Ainsi, les cristaux de benzène sont orthorhombiques.
Notez dans l'image du haut que l'inclinaison des anneaux favorise les interactions entre les Hδ+ et centres aromatiques, mentionnés dans les sous-sections précédentes.
Propriétés
Masse moléculaire
78,114 g / mol.
Apparence physique
Liquide incolore avec une odeur d'essence.
Point d'ébullition
80 ° C.
Point de fusion
5,5 ° C.
point d'allumage
-11ºC (tasse fermée).
La température d'auto-inflammation
497,78 ° C.
Densité
0,8765 g / mL à 20 ° C.
Solubilité
Un litre d'eau bouillante peut à peine dissoudre 3,94 g de benzène. Son caractère non polaire le rend pratiquement non miscible à l'eau. Cependant, il est miscible avec d'autres solvants, tels que l'éthanol, les éthers, l'acétone, les huiles, le chloroforme, le tétrachlorure de carbone, etc..
Densité de vapeur
2,8 par rapport à l'air (soit presque trois fois plus dense).
La pression de vapeur
94,8 mm Hg à 25 ° C.
Chaleur de combustion
-3267,6 kJ / mol (pour le benzène liquide).
Chaleur de vaporisation
33,83 kJ / mol.
Tension superficielle
28,22 mN / m à 25 ° C.
Indice de réfraction
1,5011 à 20 ° C.
Dérivés
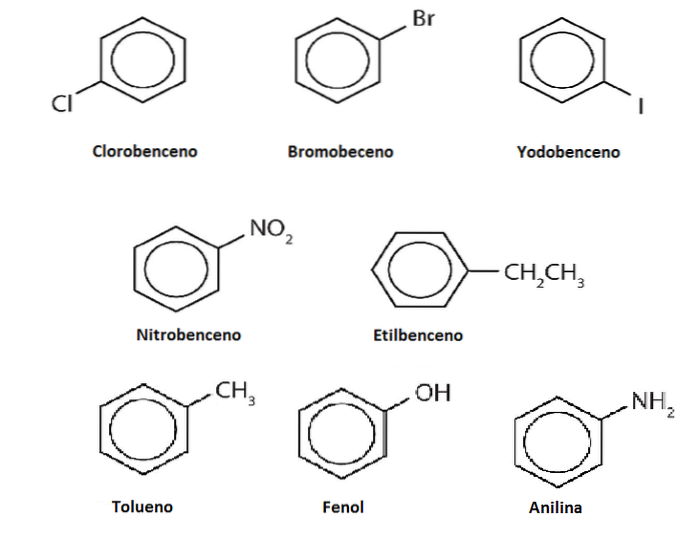
Les hydrogènes du benzène peuvent être remplacés par d'autres groupes ou atomes. Il peut y avoir une ou plusieurs substitutions, augmentant le degré de substitution jusqu'à ce qu'aucun des six hydrogènes d'origine ne reste.
Par exemple, supposons que le benzène soit Ph-H, où H est l'un de ses six hydrogènes. En se rappelant que le centre de l'anneau a une densité d'électrons plus élevée, il attire les électrophiles, qui attaquent l'anneau pour remplacer H dans une réaction appelée substitution aromatique électrophile (SEAr).
Si ce H est remplacé par un OH, on aura le Ph-OH, phénol; étant remplacé par un CH3, Ph-CH3, toluène; si c'est NHdeux, Ph-NHdeux, aniline; ou si c'est le CHdeuxCH3, Ph-CHdeuxCH3, éthylbenzène.
Les dérivés peuvent être identiques ou plus toxiques que le benzène, ou au contraire, ils peuvent devenir si complexes qu'ils ont un effet pharmacologique souhaitable..
Applications
C'est un bon solvant pour une grande variété de composés, présents par exemple dans les peintures, vernis, adhésifs et revêtements.
Il peut également dissoudre des huiles, des graisses ou des cires, c'est pourquoi il a été utilisé comme solvant d'extraction pour les essences. Cette propriété a été utilisée par Ludwig Roselius en 1903 pour décaféiner le café, une opération qui n'est plus utilisée en raison de la toxicité du benzène. De même, il était utilisé dans le passé pour dégraisser les métaux.
Dans l'une de ses utilisations classiques, il n'agit pas comme solvant mais comme additif: augmenter l'indice d'octane de l'essence, remplacer le plomb à cet effet..
Les dérivés du benzène peuvent avoir différentes utilisations; certains servent de pesticides, lubrifiants, détergents, plastiques, explosifs, parfums, colorants, colles, médicaments, etc. Si un cycle benzénique est observé dans sa structure, il est fort probable que sa synthèse ait commencé à partir du benzène.
Parmi ses dérivés les plus importants sont: le cumène, le xylène, l'aniline, le phénol (pour la synthèse des résines phénoliques), l'acide benzoïque (conservateur), le cyclohexane (pour la synthèse du nylon), le nitrobenzène, le résorcinol et l'éthylbenzène.
Nomenclature
La nomenclature des dérivés du benzène varie en fonction du degré de substitution, de la nature des groupes substituants et de leurs positions relatives. Ainsi, le benzène peut subir des substitutions mono, di, tri, tétra, etc.
Lorsque les deux groupes sont liés à des carbones adjacents, la désignation «ortho» est utilisée; s'il y a un carbone entre les séparant, «méta»; et si les carbones sont dans des positions opposées, 'para'.
Les images ci-dessous montrent des exemples de dérivés du benzène avec leurs noms respectifs régis par l'IUPAC. Ils sont également accompagnés de noms communs ou traditionnels.
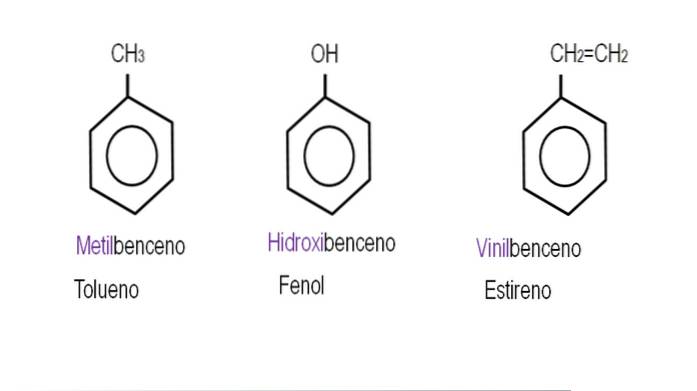
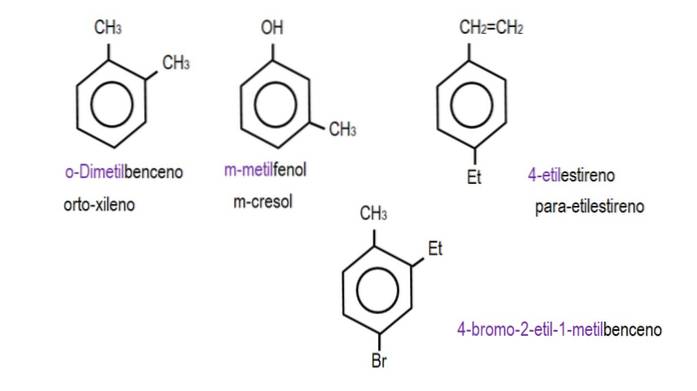
Notez que dans le benzène trisubstitué, les indicateurs ortho, para et méta ne sont plus utiles..
Toxicité
Le benzène est un composé qui doit être manipulé avec précaution. Compte tenu de son odeur particulière, les effets négatifs immédiats peuvent être une suffocation, des étourdissements, des maux de tête, des tremblements, de la somnolence, des nausées et même la mort (avec une exposition élevée). S'il est ingéré, en plus de ce qui précède, il peut provoquer de graves douleurs à l'estomac et des convulsions..
De plus, les effets à long terme d'une exposition constante à ce liquide sont cancérigènes; augmente les chances que l'individu souffre d'un type de cancer, en particulier d'un cancer du sang: leucémie.
Dans le sang, il peut diminuer la concentration de globules rouges, provoquant une anémie, et également affecter la moelle osseuse et le foie, où il est assimilé par le corps pour générer des dérivés du benzène encore plus toxiques; par exemple, l'hydroxyquinone. Il s'accumule également dans les reins, le cœur, les poumons et le cerveau..
Les références
- Morrison et R.T. et Boyd, R. N. (1987). Chimie organique. (5e édition). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Chimie organique. (6e édition). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Centre national d'information sur la biotechnologie. (2019). Benzène. Base de données PubChem. CID = 241, récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2019). Benzène. Récupéré de: en.wikipedia.org
- Garcia Nissa. (2019). Qu'est-ce que le benzène? - Utilisations, structure et formule. Étude. Récupéré de: study.com
- Centres pour le Contrôle et la Prévention des catastrophes. (04 avril 2018). Faits sur le benzène. Récupéré de: Emergency.cdc.gov
- Organisation mondiale de la santé. (2010). Exposition au benzène: un problème majeur de santé publique. [PDF]. Récupéré de: who.int
- Fernández Germán. (s.f.). Problèmes de nomenclature du benzène. Chimie organique. Récupéré de: quimicaorganica.org



Personne n'a encore commenté ce post.