
Acides et bases forts et faibles

Une classification des acides et des bases en chimie dépend de la force d'ionisation de ces substances en milieu aqueux. A) Oui:
- une l'acide et une base sont forts lorsqu'ils sont complètement ionisés, c'est-à-dire lors du processus d'ionisation, ils sont complètement transformés en cations ou ions positifs et en anions ou ions négatifs.
- D'un autre côté, un acide et une base sont faibles lorsqu'ils sont partiellement ionisés dans l'eau, c'est-à-dire qu'il y aura en solution une proportion de cations, une autre proportion d'anions et une autre proportion de molécules non dissociées.
| Acides et bases forts | Acides et bases faibles | |
|---|---|---|
| Définition | Substances qui s'ionisent complètement en solution. | Substances qui s'ionisent partiellement en solution. |
| Ionisation | Compléter | Partiel |
| Éléments en solution aqueuse | Cations et anions dans la même concentration. | Cations, anions et molécules dans différentes proportions. |
| Constante d'ionisation | Élevé | Petite |
| Exemples |
|
|
Acides et bases forts
UNE l'acide ou une base sont forts lorsqu'ils se dissocient complètement en milieu aqueux, c'est-à-dire que le processus d'ionisation est terminé et que la solution aura la même concentration d'anions que les cations.
Comment ioniser un acide et une base forte??
Un acide fort, tel que l'acide chlorhydrique HCl, s'ionise des manières suivantes:
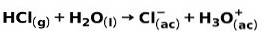
Une base forte, telle que l'hydroxyde de sodium NaOH, s'ionise des manières suivantes:
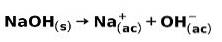
Exemples d'acides forts et leurs formules
| Acides forts | Formule |
|---|---|
| Acide chlorhydrique | HCl |
| Acide sulfurique | HdeuxSW4 |
| Acide nitrique | HNO3 |
| Acide bromhydrique | HBr |
| Acide perchlorique | HClO4 |
| Acide chromique | HdeuxCrO4 |
| Acide tétrafluroborique | HBF4 |
Exemples de bases fortes et leurs formules
| Base solide | Formule |
|---|---|
| Hydroxyde de sodium | NaOH |
| Hydroxyde de lithium | LiOH |
| L'hydroxyde de potassium | KOH |
| Hydroxyde de rubidium | RbOH |
| Hydroxyde de césium | CsOH |
| Hydroxyde de calcium | Ca (OH)deux |
| Hydroxyde de baryum | Ba (OH)deux |
| Hydroxyde de strontium | Sr (OH)deux |
| Hydroxyde d'aluminium | Al (OH)3 |
Vous voudrez peut-être voir plus d'exemples d'acides et de bases.
Acides et bases faibles
UNE L'acide ou la base est faible lorsqu'il est partiellement ionisé en solution aqueuse, c'est-à-dire que dans la solution, il y a des ions et des molécules non ionisées.
Comment ioniser un acide et une base faible??
Un acide faible, tel que l'acide acétique CH3COOH, est ionisé de la manière suivante:
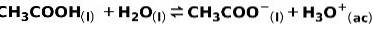
L'équilibre de cette réaction est exprimé par les deux flèches dans des directions opposées.
Lorsqu'un acide faible se dissocie ou s'ionise, un équilibre s'établit entre les espèces présentes dans la solution; cela peut être exprimé par un constante d'ionisation aigre:
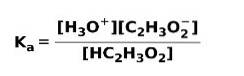
La constante d'ionisation n'est rien d'autre que le rapport entre la multiplication de la concentration des produits sur la multiplication de la concentration des réactifs.
Une base faible, telle que l'ammoniac NH3, s'ionise de la manière suivante:
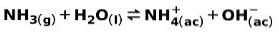
Lorsqu'une base faible se dissocie ou s'ionise, un équilibre s'établit entre les espèces présentes dans la solution; cela peut être exprimé par un constante d'ionisation de base:
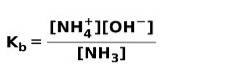
Vous voudrez peut-être connaître la différence entre les acides et les bases.
Exemples d'acides faibles avec leur formule et leur constante d'ionisation acide Kà
| Acide faible | Formule | Constante d'ionisation |
|---|---|---|
| Acide formique | HdeuxCOdeux | 1,77 x 10-4 |
| Acide acétique | H3CCOH | 1,75 x 10-5 |
| Acide cyanhydrique | HOCN | 3,30 x 10-4 |
| Cyanure d'hydrogène | HCN | 6,20 x 10-dix |
| Acide hypochloreux | HOCl | 3,50 x 10-8 |
| Acide nitreux | HNOdeux | 4,00 x 10-4 |
| Acide lactique | HC3H5OU ALORS3 | 1,40 x 10-4 |
| Acide carbonique | HdeuxCO3 | 4,30 x 10-7 5,60 x 10-Onze |
| Acide borique | H3BO3 | 5,80 x 10-dix 1,80 x 10-13 3,00 x 10-14 |
Exemples de bases faibles avec leur formule et leur constante d'ionisation basique Kb
| Base faible | Formule | Constante d'ionisation |
|---|---|---|
| Ammoniac | NH3 | 1,75 x 10-5 |
| Méthylamine | CH3NHdeux | 4,38 x 10-4 |
| Éthylamine | CdeuxH5NHdeux | 5,60 x 10-4 |
| Aniline | C6H5NHdeux | 3,80 x 10-dix |
| Pyridine | C5H5N | 1,70 x 10-9 |
| Benzylamine | C7H9N | 2,20 x 10-5 |
| Bicarbonate de sodium | NaHCO | 2,00 x 10-4 |
Vous voudrez peut-être en savoir plus sur les caractéristiques des acides et des bases


Personne n'a encore commenté ce post.