
Caractéristiques des sphingolipides, fonctions, groupes, synthèse

Les sphingolipides ils représentent l'une des trois grandes familles de lipides présentes dans les membranes biologiques. Comme les glycérophospholipides et les stérols, ce sont des molécules amphipathiques avec une région polaire hydrophile et une région apolaire hydrophobe..
Ils ont été décrits pour la première fois en 1884 par Johann L. W. Thudichum, qui a décrit trois sphingolipides (sphingomyéline, cérébrosides et cérébrosulfatide) appartenant aux trois classes connues: les phosphoesphingolipides, les glycosphingolipides neutres et acides..
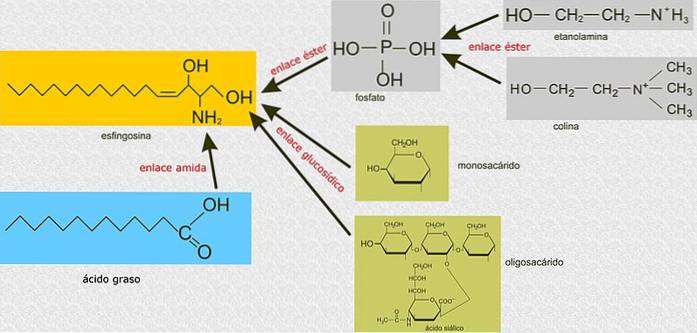
Contrairement aux glycérophospholipides, les sphingolipides ne sont pas construits sur une molécule de glycérol 3-phosphate comme squelette principal, mais sont des composés dérivés de la sphingosine, un alcool aminé avec une longue chaîne hydrocarbonée liée par une liaison amide..
En termes de complexité et de diversité, au moins 5 types de bases différents sont connus pour les sphingolipides chez les mammifères. Ces bases peuvent être jointes par plus de 20 types différents d'acides gras, avec des longueurs et des degrés de saturation variables, en plus des multiples variations des groupes polaires qui peuvent se produire..
Les membranes biologiques contiennent environ 20% de sphingolipides. Ceux-ci ont des fonctions variées et importantes dans les cellules, de la transduction structurelle à la transduction du signal, et le contrôle de différents processus de communication cellulaire..
La distribution de ces molécules varie en fonction de la fonction de l'organite où elles se trouvent, mais normalement la concentration de sphingolipides est beaucoup plus élevée dans la monocouche externe de la membrane plasmique par rapport à la monocouche interne et d'autres compartiments..
Chez l'homme, il existe au moins 60 espèces de sphingolipides. Beaucoup d'entre eux sont des composants importants des membranes des cellules nerveuses, tandis que d'autres jouent des rôles structurels importants ou participent à la transduction du signal, à la reconnaissance, à la différenciation cellulaire, à la pathogenèse, à la mort cellulaire programmée, entre autres..
Index des articles
- 1 Structure
- 2 caractéristiques
- 3 fonctions
- 3.1 -Fonctions structurelles
- 3.2 -Fonctions de signalisation
- 3.3 -En tant que récepteurs dans la membrane
- 4 groupes de sphingolipides
- 4.1 Sphingomyélines
- 4.2 Glycolipides ou glycosphingolipides neutres (sans frais)
- 4.3 Gangliosides acides ou glycosphingolipides
- 5 Synthèse
- 5.1 Synthèse du squelette céramide
- 5.2 Formation de sphingolipides spécifiques
- 6 Métabolisme
- 6.1 Réglementation
- 7 Références
ETstructure
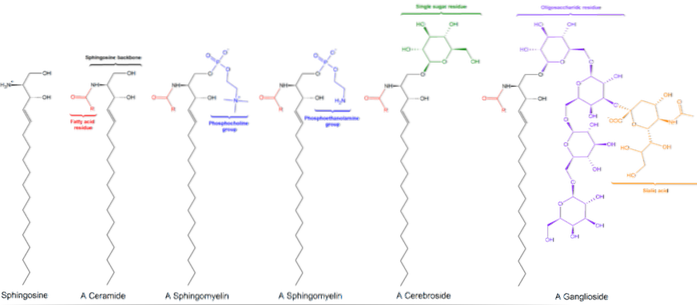
Tous les sphingolipides sont dérivés d'une L-sérine, qui est condensée avec un acide gras à longue chaîne pour former la base sphingoïde, également connue sous le nom de base à longue chaîne (LCB)..
Les bases les plus courantes sont la sphinganine et la sphingosine, qui ne diffèrent l'une de l'autre qu'en présence d'une double liaison trans entre les carbones 4 et 5 de l'acide gras de la sphingosine.
Les carbones 1, 2 et 3 de la sphingosine sont structurellement analogues aux carbones du glycérol des glycérophospholipides. Lorsqu'un acide gras est attaché au carbone 2 de la sphingosine par des liaisons amide, un céramide est produit, qui est une molécule très similaire au diacylglycérol et représente le sphingolipide le plus simple..
Les acides gras à longue chaîne qui composent les régions hydrophobes de ces lipides peuvent être très diversifiés. Les longueurs varient de 14 à 22 atomes de carbone qui peuvent avoir différents degrés de saturation, généralement entre les carbones 4 et 5.
En positions 4 ou 6, ils peuvent avoir des groupes hydroxyle et des doubles liaisons dans d'autres positions ou même des ramifications comme des groupes méthyle.
Caractéristiques
Les chaînes d'acides gras liées par des liaisons amide aux céramides sont généralement saturées et ont tendance à être plus longues que celles que l'on trouve dans les glycérophospholipides, ce qui semble être crucial pour leur activité biologique..
Une caractéristique distinctive du squelette des sphingolipides est qu'ils peuvent avoir une charge positive nette à pH neutre, rare parmi les molécules lipidiques..
Cependant, le paqueta du groupe amino est faible par rapport à une simple amine, entre 7 et 8, de sorte qu'une partie de la molécule n'est pas chargée au pH physiologique, ce qui pourrait expliquer le mouvement «libre» de celles-ci entre les bicouches.
La classification traditionnelle des sphingolipides résulte des multiples modifications que peut subir la molécule de céramide, notamment au niveau des substitutions des groupements de la tête polaire.
Caractéristiques
Les sphingolipides sont essentiels chez les animaux, les plantes et les champignons, ainsi que dans certains organismes procaryotes et virus..
-Fonctions structurelles
Les sphingolipides modulent les propriétés physiques des membranes, y compris leur fluidité, leur épaisseur et leur courbure. La modulation de ces propriétés leur confère également une influence directe sur l'organisation spatiale des protéines membranaires..
Dans les "radeaux" lipidiques
Dans les membranes biologiques, des micro-domaines dynamiques avec moins de fluidité peuvent être détectés, constitués de molécules de cholestérol et de sphingolipides appelées radeaux lipidiques..
Ces structures se produisent naturellement et sont étroitement liées aux protéines intégrales, aux récepteurs de surface cellulaire et aux protéines de signalisation, aux transporteurs et à d'autres protéines avec des ancres glycosylphosphatidylinositol (GPI)..
-Fonctions de signalisation
Ils ont des fonctions de molécules de signalisation qui agissent en tant que seconds messagers ou en tant que ligands sécrétés pour les récepteurs de surface cellulaire..
En tant que messagers secondaires, ils peuvent participer à la régulation de l'homéostasie calcique, de la croissance cellulaire, de la tumorigenèse et de la suppression de l'apoptose. De plus, l'activité de nombreuses protéines membranaires intégrales et périphériques dépend de leur association avec les sphingolipides..
De nombreuses interactions entre les cellules et la cellule avec son environnement dépendent de l'exposition des différents groupes polaires de sphingolipides à la face externe de la membrane plasmique..
La liaison des glycosphingolipides et des lectines est cruciale pour l'association de la myéline avec les axones, l'adhésion des neutrophiles à l'endothélium, etc..
Sous-produits de votre métabolisme
Les sphingolipides de signalisation les plus importants sont les bases à longue chaîne ou les sphingosines et les céramides, ainsi que leurs dérivés phosphorylés, tels que la sphingosine 1-phosphate.
Les produits métaboliques de nombreux sphingolipides activent ou inhibent plusieurs cibles en aval (protéines kinases, phosphoprotéines phosphatases et autres), qui contrôlent des comportements cellulaires complexes tels que la croissance, la différenciation et l'apoptose..
-En tant que récepteurs sur la membrane
Certains agents pathogènes utilisent des glycosphingolipides comme récepteurs pour médier leur entrée dans les cellules hôtes ou pour leur fournir des facteurs de virulence..
Il a été démontré que les sphingolipides participent à de multiples événements cellulaires tels que la sécrétion, l'endocytose, la chimiotaxie, la neurotransmission, l'angiogenèse et l'inflammation..
Ils sont également impliqués dans le trafic membranaire, influençant ainsi l'internalisation des récepteurs, l'ordre, le mouvement et la fusion des vésicules sécrétoires en réponse à différents stimuli..
Groupes de sphingolipides
Il existe trois sous-classes de sphingolipides, tous dérivés du céramide et différant les uns des autres par des groupes polaires, à savoir: les sphingomyélines, les glycolipides et les gangliosides..
Sphingomyélines

Ceux-ci contiennent de la phosphocholine ou de la phosphoéthanolamine en tant que groupe de tête polaire, c'est pourquoi ils sont classés comme phospholipides avec les glycérophospholipides. Ils ressemblent, bien entendu, aux phosphatidylcholines par leur structure tridimensionnelle et leurs propriétés générales puisqu'ils n'ont aucune charge sur leurs têtes polaires..
Ils sont présents dans les membranes plasmiques des cellules animales et sont particulièrement abondants dans la myéline, une gaine qui entoure et isole les axones de certains neurones.
Glycolipides ou glycosphingolipides neutres (sans frais)
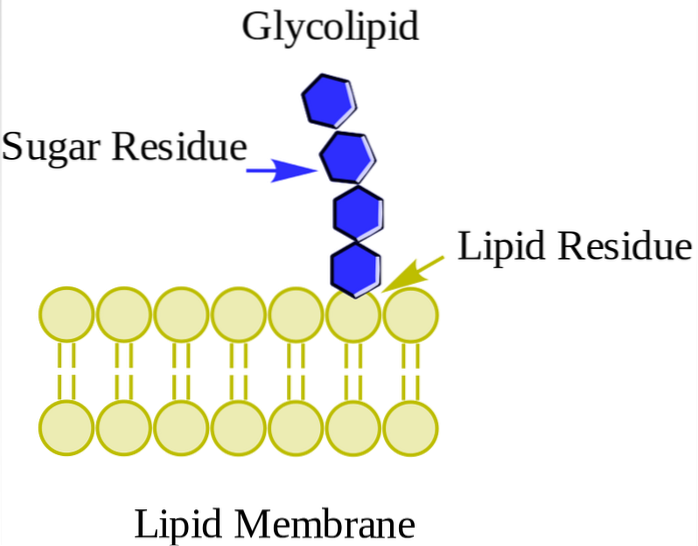
Ils se trouvent principalement sur la face externe de la membrane plasmique et ont un ou plusieurs sucres en tant que groupe de tête polaire attaché directement à l'hydroxyle du carbone 1 de la partie céramide. Ils n'ont pas de groupes phosphate. Puisqu'à pH 7, ils n'ont pas de charge, ils sont appelés glycolipides neutres.
Les cérébrosides ont une seule molécule de sucre attachée au céramide. Ceux contenant du galactose se trouvent dans les membranes plasmiques des cellules non nerveuses des tissus. Les globosides sont des glycosphingolipides contenant au moins deux sucres, généralement du D-glucose, du D-galactose ou de la N-acétyl-D-galactosamine..
Gangliosides acides ou glycosphingolipides
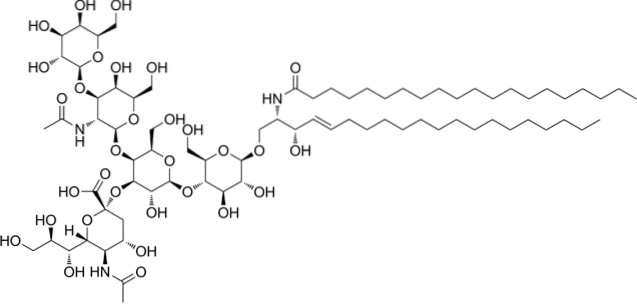
Ce sont les sphingolipides les plus complexes. Ils ont des oligosaccharides comme groupe de tête polaire et un ou plusieurs résidus d'acide N-acétylmuramique terminaux, également appelés acide sialique. L'acide sialique donne aux gangliosides une charge négative à pH 7, ce qui les distingue des glycosphingolipides neutres.
La nomenclature de cette classe de sphingolipides dépend de la quantité de résidus d'acide sialique présents dans la partie oligosaccharidique de la tête polaire..
La synthèse
La molécule de base à longue chaîne, ou sphingosine, est synthétisée dans le réticulum endoplasmique (RE) et l'ajout du groupe polaire à la tête de ces lipides se produit plus tard dans le complexe de Golgi. Chez les mammifères, une certaine synthèse de sphingolipides peut également se produire dans les mitochondries.
Après avoir terminé leur synthèse dans le complexe de Golgi, les sphingolipides sont transportés vers d'autres compartiments cellulaires par des mécanismes à médiation vésiculaire..
La biosynthèse des sphingolipides consiste en trois événements fondamentaux: la synthèse de bases à longue chaîne, la biosynthèse des céramides par l'union d'un acide gras par une liaison amide, et enfin, la formation de sphingolipides complexes par l'union des groupes polaires sur carbone 1 de la base du sphingoïde.
En plus de la synthèse de novo, les sphingolipides peuvent également être formés par le renouvellement ou le recyclage de bases à longue chaîne et de céramides, qui peuvent alimenter le pool de sphingolipides.
Synthèse du squelette céramide
La biosynthèse du céramide, le squelette des sphingolipides, commence par la condensation décarboxylative d'une molécule de palmitoyl-CoA et d'une L-sérine. La réaction est catalysée par une sérine palmitoyl transférase (SPT) hétérodimérique, dépendante du phosphate de pyridoxal et le produit est la 3-céto dihydrosphingosine..
Cette enzyme est inhibée par les β-halo-L-alanines et les L-cyclosérines. Chez la levure, il est codé par deux gènes, tandis que chez les mammifères, il existe trois gènes pour cette enzyme. Le site actif est situé sur la face cytoplasmique du réticulum endoplasmique.
Le rôle de cette première enzyme est conservé dans tous les organismes étudiés. Cependant, il existe des différences entre les taxons qui ont à voir avec la localisation subcellulaire de l'enzyme: celle des bactéries est cytoplasmique, celle des levures, des plantes et des animaux est dans le réticulum endoplasmique..
La 3-cétosphinganine est ensuite réduite par la 3-cétosphinganine réductase NADPH-dépendante pour produire de la sphinganine. La dihydrocéramide synthase (sphinganine N-acyl transférase) acétyle ensuite la sphinganine pour produire du dihydrocéramide. Le céramide est ensuite formé par la dihydrocéramide désaturase / réductase, qui insère une double liaison trans en position 4-5.
Chez les mammifères, il existe de nombreuses isoformes de céramide synthases, chacune liant une chaîne spécifique d'acides gras à des bases à longue chaîne. Par conséquent, les céramides synthases et d'autres enzymes, les élongases, constituent la principale source de diversité des acides gras dans les sphingolipides..
Formation spécifique de sphingolipides
La sphingomyéline est synthétisée par le transfert d'une phosphocholine de la phosphatidylcholine au céramide, libérant du diacylglycérol. La réaction lie les voies de signalisation des sphingolipides et des glycérophospholipides.
Le céramide de phosphoéthanolamine est synthétisé à partir de la phosphatidyléthanolamine et du céramide dans une réaction analogue à celle de la synthèse de la sphingomyéline, et une fois formé, il peut être méthylé en sphingomyéline. Les céramides de phosphate d'inositol sont formés par transestérification à partir du phosphatidylinositol.
Les glycosphingolipides sont modifiés principalement dans le complexe de Golgi, où des enzymes glycosyltransférases spécifiques participent à l'ajout de chaînes oligosaccharidiques dans la région hydrophile du squelette du céramide..
Métabolisme
La dégradation des sphingolipides est réalisée par les enzymes glucohydrolases et sphingomyélinases, qui sont chargées de supprimer les modifications des groupes polaires. D'autre part, les céramidases régénèrent les bases à longue chaîne à partir des céramides.
Les gangliosides sont dégradés par un ensemble d'enzymes lysosomales qui catalysent l'élimination étape par étape des unités de sucre, produisant finalement un céramide..
Une autre voie de dégradation consiste en l'internalisation des sphingolipides dans des vésicules endocytaires qui sont renvoyées vers la membrane plasmique ou transportées vers les lysosomes où elles sont dégradées par des hydrolases acides spécifiques..
Toutes les bases à longue chaîne ne sont pas recyclées, le réticulum endoplasmique a une voie pour leur dégradation terminale. Ce mécanisme de dégradation consiste en une phosphorylation au lieu de l'acylation des LCB, donnant naissance à des molécules de signalisation qui peuvent être des substrats solubles pour les enzymes lyase qui coupent les LCB-phosphate pour générer des acyloaldéhydes et de la phosphoéthanolamine..
Régulation
Le métabolisme de ces lipides est régulé à différents niveaux, l'un d'eux est celui des enzymes en charge de la synthèse, leurs modifications post-traductionnelles et leurs mécanismes allostériques..
Certains mécanismes de régulation sont spécifiques aux cellules, soit pour contrôler le moment du développement cellulaire dans lequel ils sont produits, soit en réponse à des signaux spécifiques..
Les références
- Bartke, N., et Hannun, Y. (2009). Sphingolipides bioactifs: métabolisme et fonction. Journal de recherche sur les lipides, cinquante, 19.
- Breslow, D. K. (2013). Homéostasie des sphingolipides dans le réticulum endoplasmique et au-delà. Perspectives de Cold Spring Harbor en biologie, 5(4), a013326.
- Futerman, A. H. et Hannun, Y. A. (2004). La vie complexe des sphingolipides simples. Rapports EMBO, 5(8), 777-782.
- Harrison, P. J., Dunn, T., et Campopiano, D. J. (2018). Biosynthèse des sphingolipides chez l'homme et les microbes. Rapports sur les produits naturels, 35(9), 921-954.
- Lahiri, S., et Futerman, A. H. (2007). Le métabolisme et la fonction des sphingolipides et des glycosphingolipides. Sciences de la vie cellulaires et moléculaires, 64(17), 2270-2284.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Martin, K. (2003). Biologie cellulaire moléculaire (5e éd.). Freeman, W. H. & Company.
- Luckey, M. (2008). Biologie structurale membranaire: avec des fondements biochimiques et biophysiques. La presse de l'Universite de Cambridge. Récupéré de www.cambridge.org/9780521856553
- Merrill, A. H. (2011). Voies métaboliques des sphingolipides et des glycosphingolipides à l'ère de la sphingolipidomique. Avis sur les produits chimiques, 111(10), 6387-6422.
- Nelson, D. L. et Cox, M. M. (2009). Principes de biochimie de Lehninger. Éditions Omega (5e éd.).
- Vance, J. E. et Vance, D. E. (2008). Biochimie des lipides, lipoprotéines et membranes. Dans Nouvelle biochimie complète Vol.36 (4e éd.). Elsevier.

Personne n'a encore commenté ce post.