
Structure, biosynthèse, fonctions et pathologies des globosides
Les globosides Ils sont un type de sphingolipides appartenant à la famille hétérogène des glycosphingolipides et se caractérisent par avoir dans leurs structures un groupe polaire composé de glycanes structurés complexes liés à un squelette céramide par une liaison B-glycosidique.
Ils sont classés dans la série "globe" des glycosphingolipides par la présence d'une structure centrale de la forme générale Galα4Galβ4GlcβCer, et leur nomenclature est généralement basée sur le nombre et le type de résidus sucrés des têtes polaires.
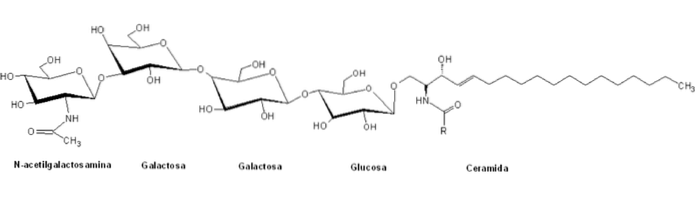
Contrairement aux autres sphingolipides, les globosides sont des constituants normaux des membranes cellulaires des organes systémiques non nerveux de nombreux mammifères. Par exemple les reins, l'intestin, les poumons, les glandes surrénales et les globules rouges.
Comme tous les lipides membranaires, les globosides ont des fonctions structurelles importantes dans la formation et l'ordre des bicouches lipidiques..
Cependant, et contrairement à leurs homologues acides ou phosphorylés, la fonction des globosides n'est pas tant liée à la production de molécules de signalisation, mais plutôt à leur participation dans le cadre des glycoconjugués dans la membrane plasmique..
Index des articles
- 1 Structure
- 2 Biosynthèse
- 2.1 Ajouter de la complexité
- 3 Emplacement
- 4 fonctions
- 5 pathologies liées
- 5.1 Maladie de Fabry
- 5.2 Maladie de Sandhoff
- 6 Références
Structure
Ils partagent certaines similitudes structurelles et fonctionnelles avec les autres membres du groupe des glucosphingolipides: cérébrosides, gangliosides et sulfatides; y compris la composition du squelette principal et les sous-produits de son métabolisme.
Cependant, les globosides diffèrent des glycosphingolipides acides (tels que les gangliosides) en ce qui concerne la charge de leurs groupes polaires glucidiques, car ils sont électriquement neutres à pH physiologique, ce qui semble avoir de fortes implications pour leurs fonctions en tant que partie de la matrice extracellulaire..
Ces groupes de tête polaire ont normalement plus de deux molécules de sucre, parmi lesquelles sont couramment le D-glucose, le D-galactose et la N-acétyl-D-galactosamine, et dans une moindre mesure le fucose et N-acétylglucosamine.
Comme pour les autres sphingolipides, les globosides peuvent être des molécules très diverses, soit en tenant compte des multiples combinaisons d'acides gras attachés au squelette de la sphingosine, soit des variations éventuelles des chaînes oligosaccharidiques de la partie hydrophile..
Biosynthèse
La voie commence par la synthèse du céramide dans le réticulum endoplasmique (RE). Le squelette de la sphingosine est d'abord formé par condensation d'une L-sérine et d'un palmitoyl-CoA.
Le céramide est ensuite généré par l'action des enzymes céramide synthase, qui condensent une autre molécule d'acide gras-CoA avec le squelette de la sphingosine au niveau du carbone en position 2.
Toujours dans l'ER, les céramides produits peuvent être modifiés par l'ajout d'un résidu galactose pour former des galactocéramides (GalCer), ou ils peuvent au contraire être transportés vers le complexe de Golgi soit par action de protéines de transfert de céramide (CERT) soit par du transport vésiculaire.
Dans le complexe de Golgi, les céramides peuvent être glycosylés pour produire des glucocéramides (GlcCer).
Ajouter de la complexité
GlcCer est produit sur la face cytosolique du Golgi précoce. Il peut ensuite être transporté vers la face luminale du complexe et ensuite être glycosylé par des enzymes glycosidases spécifiques qui génèrent des glycosphingolipides plus complexes..
Les précurseurs communs de tous les glycosphingolipides sont synthétisés dans le complexe de Golgi par l'action des glycosyltransférases de GalCer ou GlcCer.
Ces enzymes transfèrent des glucides spécifiques à partir des sucres nucléotidiques appropriés: UDP-glucose, UDP-galactose, CMP-acide sialique, etc..
Lorsque GlcCer traverse le système de trafic vésiculaire de Golgi, il est galactosylé pour produire du lactosylcéramide (LacCer). LacCer est le point de ramification à partir duquel les précurseurs des autres glycosphingolipides sont synthétisés, c'est-à-dire la molécule à laquelle des résidus de sucre polaires plus neutres sont ensuite ajoutés. Ces réactions sont catalysées par des globoside synthases spécifiques.
Emplacement
Ces lipides se trouvent principalement dans les tissus humains. Comme de nombreux glycosphingolipides, les globosides sont enrichis à l'extérieur de la membrane plasmique de nombreuses cellules..
Ils sont particulièrement importants dans les érythrocytes humains, où ils représentent le principal type de glycolipide à la surface cellulaire..
De plus, comme indiqué ci-dessus, ils font partie de l'ensemble des glycoconjugués des membranes plasmiques de nombreux organes non nerveux, principalement les reins..
Caractéristiques
Les fonctions des globosides n'ont pas été complètement élucidées à ce jour, mais on sait que certaines espèces augmentent la prolifération et la motilité cellulaires, contrairement à l'inhibition de ces événements provoquée par certains gangliosides..
Un globoside tétra-glycosylé, Gb4 (GalNAcβ3Galα4Galβ4GlcβCer), fonctionne dans la reconnaissance sensible au site des perturbations structurelles des érythrocytes au cours des processus d'adhésion cellulaire..
Des études récentes ont déterminé l'implication de Gb4 dans l'activation des protéines ERK dans des lignées cellulaires de carcinome, ce qui pourrait signifier sa participation à l'initiation tumorale. Ces protéines appartiennent à la cascade de signalisation de la protéine kinase activée par un mitogène (MAPK), constituée des éléments Raf, MEK et ERK..
Leur participation en tant que récepteurs de certaines toxines bactériennes de la famille Shiga a été rapportée, en particulier le globoside Gb3 (Galα4Galβ4GlcβCer), également connu sous le nom de CD77, exprimé dans des cellules B immatures; également en tant que récepteurs du facteur d'adhésion au VIH (gp120) et semblent avoir des implications dans certains types de cancer et d'autres maladies.
Pathologies associées
Il existe de nombreux types de lipidose chez l'homme. Les globosides et leurs voies métaboliques sont liés à deux maladies en particulier: la maladie de Fabry et la maladie de Sandhoff..
Maladie de Fabry
Il fait référence à un trouble systémique héréditaire lié au sexe, d'abord observé chez des patients présentant de multiples taches violettes dans la région ombilicale. Il affecte des organes tels que les reins, le cœur, les yeux, les extrémités, une partie du système gastro-intestinal et nerveux.
C'est le produit d'un défaut métabolique de l'enzyme céramide trihexosidase, responsable de l'hydrolyse du trihexosicéramide, intermédiaire dans le catabolisme des globosides et des gangliosides, qui provoque une accumulation de ces glycolipides dans les tissus.
Maladie de Sandhoff
Cette pathologie a été initialement décrite comme une variante de la maladie de Tay-Sachs, liée au métabolisme des gangliosides, mais cela présente également l'accumulation de globosides dans les viscères. C'est une maladie héréditaire avec des schémas autosomiques récessifs qui détruit progressivement les neurones et la moelle épinière.
Cela a à voir avec l'absence des formes A et B de l'enzyme β-N-acétyl hexosaminidase due à des mutations dans le gène HEXB. Ces enzymes sont responsables de l'une des étapes de dégradation de certains glycosphingolipides.
Les références
- Bieberich, E. (2004). Intégration du métabolisme des glycosphingolipides et des décisions relatives au devenir des cellules dans le cancer et les cellules souches: examen et hypothèse. Journal des glycoconjugués, vingt-et-un, 315-327.
- Brady, R., Gal, A., Bradley, R., Martensson, E., Warshaw, A. et Laster, L. (1967). Défaut enzymatique dans la maladie de Fabry. Le New England Journal of Medicine, 276(21), 1163-1167.
- D'Angelo, G., Capasso, S., Sticco, L., et Russo, D. (2013). Glycosphingolipides: synthèse et fonctions. Le Journal FEBS, 280, 6338-6353.
- Eto, Y. et Suzuki, K. (1971). Sphingoglycolipides du cerveau dans la leucodystrophie à cellules globoïdes de Krabbe. Journal de neurochimie, je(1966).
- Jones, D. H., Lingwood, C. A., Barber, K. R. et Grant, C. W. M. (1997). Globoside comme récepteur membranaire: une considération de la communication des oligosaccharides avec le domaine hydrophobe †. Biochimie, 31(97), 8539-8547.
- Merrill, A. H. (2011). Voies métaboliques des sphingolipides et des glycosphingolipides à l'ère de la sphingolipidomique. Avis sur les produits chimiques, 111(10), 6387-6422.
- Park, S., Kwak, C., Shayman, J. A. et Hoe, J. (2012). Le globoside favorise l'activation de l'ERK par interaction avec le récepteur du facteur de croissance épidermique. Biochimica et Biophysica Acta, 1820(7), 1141-1148.
- NOUS. Département de la santé et des services sociaux (2008). Génétique Accueil Référence Maladie de Sandhoff. Extrait de www.ghr.nlm.nih.gov/condition/sandhoff-disease#definition
- Spence, M., Ripley, B., Embil, J., et Tibbles, J. (1974). Une nouvelle variante de la maladie de Sandhoff. Pédiatre. Du boeuf., 8, 628-637.
- Tatematsu, M., Imaida, K., Ito, N., Togari, H., Suzuki, Y., et Ogiu, T. (1981). Maladie de Sandhoff. Acta Pathol. JPN, 31(3), 503-512.
- Traversier, M., Gaslondes, T., Milesi, S., Michel, S., et Delannay, E. (2018). Les lipides polaires en cosmétique: tendances récentes en matière d'extraction, de séparation, d'analyse et principales applications. Phytochem Rev, 7, 1 à 32.
- Yamakawa, T., Yokoyama, S., et Kiso, N. (1962). Structure du globoside principal des érythrocytes humains. Le journal de la biochimie, 52(3).


Personne n'a encore commenté ce post.