
Caractéristiques, types, mécanismes d'action de l'hémolysine

La hémolysine C'est une petite protéine qui provoque des pores dans la membrane cellulaire des érythrocytes et de certaines autres cellules du sang des mammifères. Il est généralement synthétisé et excrété par des bactéries pathogènes.
Cette protéine est l'une des toxines microbiennes les plus courantes et celle qui a été le mieux étudiée. Parfois, il peut provoquer une anémie hémolytique, car le nombre de canaux par lesquels l'intérieur de la cellule sort peut même provoquer une lyse cellulaire..
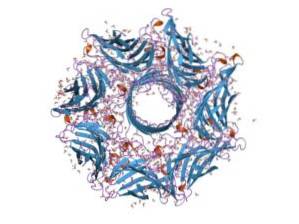
Généralement, l'hémolysine est une toxine typique des espèces de Streptocoque du tractus intestinal. Sa fonction permet aux bactéries de briser la barrière épithéliale du tractus intestinal et ainsi de se déplacer dans la circulation sanguine pour coloniser d'autres tissus..
La forme la plus courante de l'hémolysine dans la nature est sous sa forme α-hémolysine. Cette protéine est l'un des facteurs de virulence les plus importants de la plupart des souches de Escherichia coli et des clostridies.
La plupart des infections des voies urinaires sont causées par des souches de Escherichia coli produisant de l'α-hémolysine avec des caractéristiques hémolytiques.
La production d'hémolysine et de bactériocine dans les souches bactériennes a été liée à un mécanisme de compétition contre les autres espèces et la production des deux toxines semble dépendre des mêmes déterminants génétiques dans le génome de la bactérie..
Index des articles
- 1 Fonctionnalités
- 2 types
- 2.1 α-hémolysine
- 2.2 β-hémolysine
- 2,3 γ-hémolysine
- 3 Mécanismes d'action
- 3.1 Liaison membranaire
- 3.2 Insertion de toxine dans la membrane
- 3.3 oligomérisation
- 4 Références
Caractéristiques
L'hémolysine est composée de sept sous-unités et le gène qui la code a sept promoteurs. Ces sept sous-unités s'insèrent dans la membrane plasmique des cellules cibles et, lorsqu'elles se rassemblent, forment un canal ionique à travers lequel les métabolites de l'intérieur de la cellule s'échappent..
L'hémolysine est une cytotoxine extracellulaire dépendante du calcium (Ca + 2) qui agit sur la membrane plasmique des cellules sanguines. Les pores qu'il crée dans la membrane sont également hydrophiles et font pénétrer l'eau à l'intérieur de la cellule, ce qui peut entraîner une lyse..
Les hémolysines sont des produits protéiques typiques des bactéries à Gram négatif et elles partagent toutes deux caractéristiques:
1- La présence d'un très petit peptide (nonapeptide) composé de répétitions des acides aminés glycine et acide aspartique. Les nonapeptides de l'hémolysine sont situés près de la partie C-terminale de la structure primaire de la protéine.
2- Toutes les hémolysines sont sécrétées par les bactéries vers l'environnement extracellulaire via un transporteur de type ABC (ATP-Binding Cassette).
La production d'hémolysine est généralement détectée dans les souches bactériennes par croissance sur milieu gélose au sang. Dans le test, un halo hémolytique est observé, un produit de la dégradation des globules rouges à proximité des colonies de bactéries.
Les types
Il existe plusieurs types différents d'hémolysines, ceux-ci sont classés avec une lettre grecque au début de leur nom. Les plus étudiées et les plus courantes sont les hémolysines α, β et γ, toutes produites par la souche Staphylococcus aureus.
Les types d'hémolysine sont classés en fonction de la gamme de cellules qu'ils attaquent et en fonction de leur structure primaire de la protéine..
α-hémolysine
Cette protéine est typique des souches de Staphylococcus aureus Oui Escherichia coli; attaque les neutrophiles, les globules rouges, les lymphocytes, les macrophages, les fibroblastes adultes et embryonnaires. Interagit avec les têtes polaires des lipides de la membrane plasmique de ces cellules pour internaliser une queue hydrophobe d'environ 5 Ӑ à l'intérieur de la membrane.
β-hémolysine
Produit par Staphylococcus aureus Dans une moindre mesure que l'α-hémolysine, la β-hémolysine attaque principalement les érythrocytes et pénètre dans la membrane exclusivement par les domaines riches en sphingomyéline de la membrane cellulaire.
γ-hémolysine
Il a également été observé dans Staphylococcus aureus. Il a été classé à la fois comme une protéine hémolytique et une leucotoxine, car il affecte les cellules polymorphonucléaires de l'homme, les monocytes, les macrophages et rarement, même les globules rouges..
Ce type de γ-hémolysine est l'un des moins caractérisés, par conséquent, une grande partie de son mécanisme d'action est inconnu et il n'a pas été étudié. in vivo.
Mécanismes d'action
Le mécanisme d'action qui a été relativement clairement élucidé est celui de l'α-hémolysine. Cependant, comme ce sont toutes des protéines hémolytiques, on pense que la plupart des processus sont communs à toutes les hémolysines..
Les scientifiques suggèrent que pour que les bactéries sécrètent de l'hémolysine dans l'environnement, elles doivent se trouver dans un microenvironnement pauvre en nutriments, par conséquent, ce serait un mécanisme qui déclencherait la cellule pour détruire les cellules cibles et obtenir leurs nutriments..
Le mécanisme a été décrit en trois étapes: liaison à la membrane cellulaire, insertion et oligomérisation..
Liaison membranaire
Les hémolysines se sont révélées capables de se lier aux intégrines des neutrophiles et, dans les érythrocytes, ces protéines se sont liées à des composants glycosylés tels que les glycoprotéines, les gangliosides et les glycophorines de la membrane cellulaire..
Certains auteurs suggèrent que la présence de récepteurs sur la membrane n'est pas essentielle pour que la liaison des hémolysines se produise. Dans tous les cas, le mécanisme de ré-alimentation cellulaire de la protéine n'est pas encore connu avec précision..
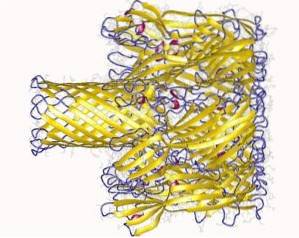
L'interaction avec la membrane se déroule en deux étapes:
- Liaison initiale (réversible): lorsque l'hémolysine se lie aux domaines de liaison au calcium de la membrane. Cette étape se produit en surface et est très sensible aux décharges électrostatiques..
- Liaison irréversible: relie les domaines d'acides aminés aux composants lipidiques de la couche externe de la membrane plasmique des cellules cibles, afin de former des liaisons physiques entre les composés hydrophobes de la membrane.
Insertion de toxine dans la membrane
La Α-hémolysine insère les résidus 177 et 411 dans la première monocouche lipidique. Dans l'environnement extracellulaire, l'hémolysine est associée aux ions calcium, qui induisent un arrangement structurel en elle et contribuent à son activation..
Cette insertion consolide l'attachement irréversible à la membrane cellulaire. Une fois l'arrangement réalisé, l'hémolysine devient une protéine intégrale puisque, expérimentalement, il a été montré que la seule façon de l'extraire de la membrane est d'utiliser des détergents tels que Triton X-100..
Oligomérisation
Lorsque toute l'hémolysine a été insérée dans la membrane plasmique des cellules cibles, l'oligomérisation des 7 sous-unités qui la composent a lieu, qui aboutit à la formation d'un pore protéique, très dynamique mais dépendant de la composition lipidique de la membrane ..
Il a été observé que le processus d'oligomérisation est favorisé par les microdomaines ou radeaux lipidiques de la membrane cellulaire. Ces régions peuvent ne pas favoriser la liaison de la protéine, mais elles favorisent son oligomérisation une fois insérées..
Plus il y a d'hémolysines qui se lient à la membrane, plus les pores se forment. De plus, les hémolysines peuvent s'oligomériser les unes les autres (celles adjacentes) et former des canaux beaucoup plus grands..
Les références
- Bakás, L., Ostolaza, H., Vaz, W. L., et Goñi, F. M. (1996). Adsorption réversible et insertion non réversible de l'alpha-hémolysine d'Escherichia coli dans les bicouches lipidiques. Revue biophysique, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, M., Viero, G., Comai, M., Potrich, C., Ferreras, M.,… et Prévost, G. (2005). Les γ-hémolysines à deux composants de Staphylococcus aureus, HlgA, HlgB et HlgC, peuvent former des pores mixtes contenant tous les composants. Journal d'information chimique et de modélisation, 45 (6), 1539-1545.
- Gow, J. A. et Robinson, J. (1969). Propriétés de la β-hémolysine staphylococcique purifiée. Journal de bactériologie, 97 (3), 1026-1032.
- Ike, Y., Hashimoto, H., et Clewell, D. B. (1984). L'hémolysine de la sous-espèce zymogenes de Streptococcus faecalis contribue à la virulence chez la souris. Infection et immunité, 45 (2), 528-530.
- Remington, J. S., Klein, J. O., Wilson, C. B., Nizet, V. et Maldonado, Y. A. (éd.). (1976). Maladies infectieuses du fœtus et du nouveau-né (Vol. 4). Philadelphie: Saunders.
- Todd, E. W. (1932). Hémolysine streptococcique antigénique. Journal de médecine expérimentale, 55 (2), 267-280.



Personne n'a encore commenté ce post.