
Caractéristiques, types et mécanisme d'hydrogénation catalytique
La hydrogénation catalytique C'est la réaction par laquelle l'hydrogène moléculaire est ajouté à un composé à des taux plus élevés. La molécule Hdeux Non seulement il doit d'abord rompre sa liaison covalente, mais aussi, étant si petit, des collisions efficaces entre lui et le composé auquel il sera ajouté sont moins probables..
Le composé récepteur d'hydrogène peut être organique ou inorganique. Dans les composés organiques, on trouve la plupart des exemples d'hydrogénation catalytique; en particulier ceux qui ont une activité pharmacologique, ou qui ont des métaux incorporés dans leurs structures (composés organométalliques).
Que se passe-t-il lorsque H est ajoutédeux à une structure pleine de carbone? Son insaturation diminue, c'est-à-dire que le carbone atteint le degré maximum de liaisons simples qu'il peut former.
Par conséquent, le Hdeux il est ajouté aux liaisons doubles (C = C) et triples (C≡C); bien qu'il puisse également être ajouté à des groupes carbonyle (C = O).
Ainsi, les alcènes et alcynes ajoutés réagissent par hydrogénation catalytique. En analysant superficiellement n'importe quelle structure, on peut prédire si oui ou non elle ajoutera Hdeux simplement en détectant les doubles et triples liaisons.
Index des articles
- 1 Caractéristiques de l'hydrogénation catalytique
- 1.1 Ruptures des liaisons hydrogène
- 1.2 Expérimental
- 2 types
- 2.1 Homogène
- 2.2 Hétérogène
- 3 Mécanisme
- 4 Références
Caractéristiques de l'hydrogénation catalytique
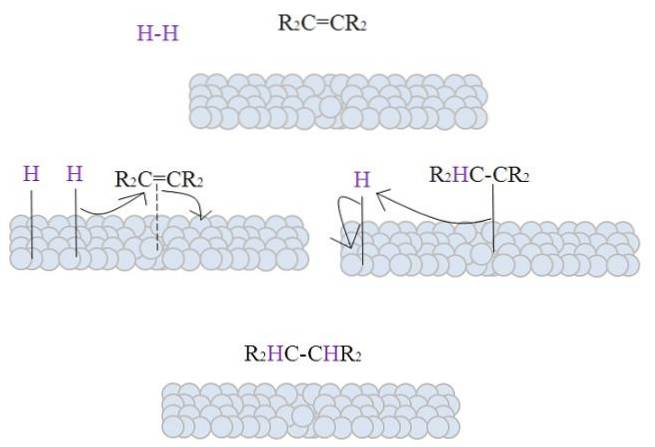
L'image montre le mécanisme de cette réaction. Cependant, il est nécessaire d'aborder certains aspects théoriques avant de le décrire.
Les surfaces des sphères grisâtres représentent les atomes métalliques qui, comme on le verra, sont les catalyseurs d'hydrogénation par excellence..
Rupture de la liaison hydrogène
Pour commencer, l'hydrogénation est une réaction exothermique, c'est-à-dire qu'elle dégage de la chaleur à la suite de la formation de composés à plus faible énergie..
Ceci s'explique par la stabilité des liaisons C-H formées, qui nécessitent plus d'énergie pour leur rupture ultérieure que celle requise par la liaison H-H de l'hydrogène moléculaire..
D'autre part, l'hydrogénation implique toujours la rupture de la liaison H-H en premier. Cette rupture peut être homolytique, comme cela se produit dans de nombreux cas:
H-H => H ∙ + ∙ H
Ou hétérolytique, qui peut se produire, par exemple, lorsque l'oxyde de zinc, ZnO, est hydrogéné:
H-H => H+ + H-
Notez que la différence entre les deux ruptures réside dans la façon dont les électrons de la liaison sont répartis. S'ils sont répartis uniformément (de manière covalente), chaque H finit par conserver un électron; alors que si la partition est ionique, on se retrouve sans électrons, H+, et l'autre les gagne complètement, H-.
Les deux ruptures sont possibles en hydrogénation catalytique, bien que l'homolytique permette de céder la place au développement d'un mécanisme logique pour cela..
Expérimental
L'hydrogène est un gaz, et par conséquent, il doit être barboté et il faut s'assurer que seul il prédomine à la surface du liquide..
Par contre, le composé à hydrogéner doit être solubilisé dans un milieu, qu'il s'agisse d'eau, d'alcool, d'éther, d'esters ou d'une amine liquide; sinon l'hydrogénation se déroulerait très lentement.
Dissous le composé à hydrogéner, il doit également y avoir un catalyseur dans le milieu réactionnel. Ce sera responsable de l'accélération de la vitesse de la réaction.
Dans l'hydrogénation catalytique, on utilise souvent des métaux finement divisés de nickel, de palladium, de platine ou de rhodium, qui sont insolubles dans presque tous les solvants organiques. Il y aura donc deux phases: une phase liquide avec le composé et l'hydrogène dissous, et une phase solide, celle du catalyseur..
Ces métaux fournissent leur surface pour la réaction de l'hydrogène et du composé, de manière à accélérer la rupture des liaisons..
De même, ils diminuent l'espace de diffusion de l'espèce, augmentant le nombre de collisions moléculaires effectives. Non seulement cela, mais même la réaction a lieu à l'intérieur des pores du métal..
Les types
Homogène
On parle d'hydrogénation catalytique homogène lorsque le milieu réactionnel est constitué d'une seule phase. Ici, il n'y a pas de place pour l'utilisation des métaux à l'état pur, car ils sont insolubles.
Au lieu de cela, des composés organométalliques de ces métaux sont utilisés, qui sont solubles et se sont avérés avoir des rendements élevés..
L'un de ces composés organométalliques est le catalyseur de Wilkinson: chlorure de tris (triphénylphosphine) rhodium, [(C6H5)3P]3RhCl. Ces composés forment un complexe avec Hdeux, l'activer pour sa réaction d'addition ultérieure à un alcène ou à un alcyne.
L'hydrogénation homogène a beaucoup plus d'alternatives que l'hydrogénation hétérogène. Parce que? Car la chimie est que les composés organométalliques sont abondants: il suffit de changer le métal (Pt, Pd, Rh, Ni) et les ligands (les molécules organiques ou inorganiques liées au centre métallique), pour obtenir un nouveau catalyseur.
Hétérogène
L'hydrogénation catalytique hétérogène, comme on vient de le mentionner, comporte deux phases: l'une liquide et l'autre solide..
En plus des catalyseurs métalliques, il y en a d'autres qui consistent en un mélange solide; par exemple, le catalyseur de Lindlar, qui est composé de platine, de carbonate de calcium, d'acétate de plomb et de quinoléine.
Le catalyseur Lindlar a la particularité d'être déficient pour l'hydrogénation des alcènes; Cependant, il est très utile pour les hydrogénations partielles, c'est-à-dire qu'il fonctionne parfaitement sur les alcynes:
RC≡CR + Hdeux => RHC = CHR
Mécanisme
L'image montre le mécanisme de l'hydrogénation catalytique en utilisant du métal en poudre comme catalyseur.
Les sphères grisâtres correspondent à la surface métallique, par exemple, du platine. La molécule Hdeux (couleur violette) se rapproche de la surface du métal comme le fait un alcène tétra-substitué, RdeuxC = CRdeux.
Le Hdeux il interagit avec les électrons qui voyagent à travers les atomes du métal, et une rupture et la formation d'une liaison temporaire H-M se produit, où M est le métal. Ce processus est connu sous le nom de chimisorption; c'est-à-dire une adsorption par des forces chimiques.
L'alcène interagit de la même manière, mais la liaison est formée par sa double liaison (ligne pointillée). La liaison H-H s'est déjà dissociée et chaque atome d'hydrogène reste lié au métal; de la même manière qu'il le fait avec les centres métalliques dans les catalyseurs organométalliques, formant un complexe intermédiaire H-M-H.
Ensuite, il y a une migration d'un H vers la double liaison, et celle-ci s'ouvre en formant une liaison avec le métal. Le H restant se lie alors à l'autre carbone de la double liaison d'origine, et l'alcane produit, R, est finalement libéré.deuxHC-CHRdeux.
Ce mécanisme sera répété autant de fois que nécessaire, jusqu'à ce que tous les Hdeux ont pleinement réagi.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Lew J. (s.f.). Hydrogénation catalytique des alcènes. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Jones D. (2018). Qu'est-ce que l'hydrogénation catalytique? - Mécanisme et réaction. Étude. Récupéré de: study.com


Personne n'a encore commenté ce post.