
Propriétés, réactivité et utilisations de l'hydrure de calcium (CaH2)

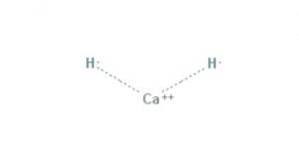
le hydrure de calcium C'est un composé chimique de formule CaH2, ce qui en fait un hydrure alcalino-terreux. Ce composé chimique a deux liaisons ioniques entre le calcium et les deux ions hydrure, comme le montre la figure 1.
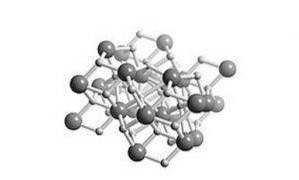
C'est un hydrure salin, ce qui signifie que sa structure est similaire à celle du sel. Sa structure cristalline est la même que celle du chlorure de plomb (cotunnite minérale) comme le montre la figure 2.
Tous les métaux alcalins et alcalino-terreux forment des sels d'hydrure. En chimie, un hydrure est l'anion de l'hydrogène, H- ou, plus communément, c'est un composé dans lequel un ou plusieurs centres hydrogène ont des propriétés nucléophiles, réductrices ou basiques.
Dans les composés considérés comme des hydrures, l'atome d'hydrogène est lié à un élément ou un groupe plus électropositif.
Il peut être produit en faisant réagir du calcium et de l'hydrogène à une température comprise entre 300 et 400 degrés Celsius. Une autre façon de préparer l'hydrure de calcium consiste à chauffer le chlorure de calcium avec de l'hydrogène et du sodium métallique. La réaction se produit comme suit:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Dans cette réaction, le calcium (Ca) et l'hydrogène (H) créent une molécule d'hydrure de calcium tandis que les atomes de sodium avec le chlore créent des molécules de chlorure de sodium (NaCl)..
L'hydrure de calcium peut également être produit en réduisant l'oxyde de calcium (CaO) avec du magnésium (Mg). La réaction est effectuée en présence d'hydrogène. Cette réaction produit également de l'oxyde de magnésium (MgO). Voici la formule de cette réaction chimique:
CaO + Mg + H2 → CaH2 + MgO
Index des articles
- 1 Propriétés physiques et chimiques de l'hydrure de calcium
- 2 Réactivité et dangers
- 3 Manipulation et stockage
- 4 Utilisations et applications
- 4.1 Agent déshydratant
- 4.2 Production d'hydrogène
- 4.3 Agent réducteur
- 5 Inconvénient de l'utilisation de l'hydrure de calcium
- 6 Références
Propriétés physiques et chimiques de l'hydrure de calcium
L'hydrure de calcium est un ensemble de cristaux avec une structure orthorhombique de couleur blanche à l'état pur. Généralement, il est rare de le trouver sous cette forme donc il a généralement une teinte grisâtre. Il manque une odeur caractéristique. Son aspect est illustré à la figure 3 (Royal Society of Chemistry, 2015).

Il a un poids moléculaire de 42,094 g / mol, un point de fusion de 816 degrés Celsius et une densité de 1,70 g / ml. S'il se dissout dans l'eau, il réagit violemment en produisant de l'hydrogène. Réagit également avec l'alcool (National Center for Biotechnology Information., S.F.).
Réactivité et dangers
L'hydrure de calcium est un produit chimique stable, bien qu'il soit très réactif à l'eau ou à l'humidité. Au contact de l'eau, il libère des gaz d'hydrogène inflammables qui peuvent s'enflammer spontanément.
Il est considéré comme un composé explosif. Lorsqu'il est chauffé dans une réaction avec le tétrahydrofurane, il peut provoquer une explosion. Lorsqu'il est mélangé avec du chlorate, de l'hypochlorite, du bromate, du perchlorate de potassium, il devient sensible à la chaleur, au frottement et devient explosif (Calcium Hydride 7789-78-8, 2016).
Lorsque le fluorure d'argent est écrasé avec de l'hydrure de calcium, la masse devient incandescente. Un fort chauffage de l'hydrure avec du chlore, du brome ou de l'iode conduit à une incandescence.
Des mélanges de l'hydrure avec divers bromates, par exemple le bromate ou les chlorates de baryum, par exemple le chlorate de baryum et des perchlorates tels que le perchlorate de potassium, explosent lors du broyage. CaH2 réagit de manière incandescente avec le fluorure d'argent s'il est soumis à des frottements.
Ce composé doit être manipulé sous atmosphère inerte. S'il n'est pas manipulé correctement, il peut constituer une menace sérieuse pour la santé et la sécurité du personnel de laboratoire, des premiers intervenants et des manipulateurs de déchets chimiques (UC center for Laboratory safety, 2013).
Extrêmement dangereux en cas de contact avec la peau ou les yeux, car c'est un irritant. Très dangereux en cas de contact avec la peau car il peut être corrosif.
Il est également dangereux en cas d'ingestion et d'inhalation. L'ampleur des lésions tissulaires dépend de la durée du contact. Le contact avec les yeux peut entraîner des lésions cornéennes ou la cécité..
Le contact avec la peau peut provoquer une inflammation et des cloques. L'inhalation de poussière provoquera une irritation des voies gastro-intestinales ou respiratoires, caractérisée par des brûlures, des éternuements et de la toux..
Une surexposition sévère peut entraîner des lésions pulmonaires, une suffocation, une perte de conscience et même la mort. L'inflammation de l'œil se caractérise par une rougeur, un larmoiement et des démangeaisons. L'inflammation de la peau est caractérisée par des démangeaisons, une desquamation, des rougeurs ou parfois des cloques.
Une exposition oculaire répétée à un faible niveau peut provoquer une irritation des yeux. Une exposition cutanée répétée peut provoquer une destruction cutanée locale ou une dermatite..
L'inhalation répétée de poussière peut produire divers degrés d'irritation respiratoire ou de lésions pulmonaires. L'inhalation répétée ou prolongée de poussières peut provoquer une irritation respiratoire chronique (Fiche signalétique Hydrure de calcium MSDS, 2005).
En cas de contact avec les yeux, ils doivent être rincés immédiatement à grande eau pendant au moins 15 minutes, en soulevant de temps en temps les paupières supérieures et inférieures..
En cas de contact avec la peau, rincer immédiatement et abondamment à l'eau pendant au moins 15 minutes tout en enlevant les vêtements et les chaussures contaminés..
En cas d'ingestion, les vomissements ne doivent pas être provoqués. Un centre antipoison devrait être appelé. Il est conseillé de quitter le lieu d'exposition et de se déplacer immédiatement à l'air libre.
En cas d'inhalation, si la respiration est difficile, il est nécessaire de fournir de l'oxygène. La réanimation bouche-à-bouche ne doit pas être administrée si la victime a avalé ou inhalé la substance..
La respiration artificielle doit être induite à l'aide d'un masque de poche équipé d'une valve unidirectionnelle ou d'un autre appareil médical respiratoire approprié. Dans tous les cas, une attention médicale doit être obtenue immédiatement..
Manipulation et stockage
Le composé doit être conservé dans un récipient sec à l'abri de la chaleur. Il doit être tenu à l'écart des sources d'ignition. La poussière ne doit pas être respirée. L'eau ne doit pas être ajoutée à ce produit
En cas de ventilation insuffisante, porter un équipement respiratoire approprié tel qu'un masque filtrant. En cas d'exposition, consultez un médecin et affichez l'étiquette si possible. Eviter le contact avec la peau et les yeux.
Les matières inflammables, en général, doivent être stockées dans un placard de sécurité séparé ou une salle de stockage. Gardez le récipient bien fermé.
Conserver dans un endroit frais et bien ventilé. Tout équipement contenant du matériel doit être mis à la terre pour éviter les étincelles électriques. Le récipient doit être conservé au sec et dans un endroit frais.
C'est un matériau ininflammable. Cependant, les pompiers doivent porter un équipement approprié lorsqu'ils combattent un incendie autour de ce composé chimique..
Il n'est jamais conseillé d'utiliser de l'eau pour éteindre un feu autour de l'hydrure de calcium. Du sable sec, ainsi que des composés tels que le chlorure de sodium et le carbonate de sodium peuvent être utilisés à cette fin..
Pour éliminer les déchets d'hydrure de calcium, il faut le décomposer en ajoutant 25 ml de méthanol pour chaque gramme d'hydrure sous une atmosphère d'azote tout en agitant..
Une fois la réaction terminée, le même volume d'eau est ajouté au composé aqueux de méthylate de calcium et il est jeté dans le drain avec beaucoup d'eau (National Research Council, 1995).
Utilisations et applications
Agent déshydratant
L'hydrure de potassium est un desséchant relativement doux. Pour cette raison, l'utilisation de ce composé comme déshydratant est plus sûre par rapport à des agents plus réactifs, tels que les alliages métalliques sodium-potassium et sodium. Réagit avec l'eau comme suit:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Les produits d'hydrolyse de cette réaction, l'hydrogène (gaz) et le Ca (OH) 2 (un mélange aqueux), peuvent être séparés du solvant chimique après un processus de filtration, distillation ou décantation..
Ce composé chimique est un déshydratant efficace pour de nombreux solvants basiques tels que les amines et la pyridine. Parfois utilisé pour pré-sécher les solvants avant d'utiliser des desséchants plus réactifs.
Production d'hydrogène
Dans les années 40, ce composé était disponible comme source d'hydrogène sous le nom commercial «Hydrolith»..
Il est utilisé depuis longtemps comme source d'hydrogène. Il est toujours utilisé pour produire de l'hydrogène pur dans les laboratoires pour diverses expériences, des piles à combustible avancées et des applications de batteries (American Elements, S.F.).
Le composé est largement utilisé depuis des décennies comme moyen sûr et pratique de gonfler les ballons météorologiques..
Il est également régulièrement utilisé dans les laboratoires pour produire de petites quantités d'hydrogène très pur pour des expériences. La teneur en humidité du carburant diesel est calculée à partir de l'hydrogène développé après traitement avec CaH2.
Agent réducteur
Lorsqu'il est chauffé entre 600 et 1000 degrés centigrades, l'oxyde de zirconium, le niobium, l'uranium, le chrome, le titane, le vanadium et le tantale peuvent être réduits pour préparer la poudre de ces métaux, de sorte que l'hydrure de calcium peut être utilisé dans la métallurgie des poussières.
La réaction suivante illustre comment l'hydrure de calcium agit comme agent réducteur:
TiO + 2CaH2 → CaO + H2 + Ti
Inconvénient de l'utilisation de l'hydrure de calcium
Ce composé chimique est souvent le choix préféré comme agent de séchage; Cependant, il présente également certains inconvénients:
-L'action de séchage de ce composé est lente, car il n'est soluble dans aucun solvant avec lequel il ne réagit pas violemment..
-Ce composé en poudre est incompatible avec de nombreux solvants. Sa réaction avec les chlorocarbures peut même provoquer des explosions.
-Il ne peut pas être utilisé pour désoxygéner les solvants car il n'est pas capable d'éliminer l'oxygène dissous.
-La différenciation entre l'hydrure de calcium et l'hydroxyde de calcium est assez difficile en raison de leurs apparences similaires.
Les références
- Éléments américains. (S.F.). hydrure de calcium. Récupéré de americanelements.com: americanelements.com.
- Hydrure de calcium 7789-78-8. (2016). Récupéré de Chemicalbook.com: Chemicalbook.com.
- hydrure de calcium. (s.f.). Récupéré de l'apprenant en chimie: chemistrylearner.com.
- Fiche signalétique Hydrure de calcium MSDS. (2005, 10 octobre). Récupéré de sciencelab.com: sciencelab.com.
- Centre national d'information sur la biotechnologie. (S.F.). Base de données des composés PubChem; CID = 105052. Récupéré de pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- Conseil National de Recherche. (Année mille neuf cents quatre-vingts-quinze). Pratiques prudentes en laboratoire: manipulation et élimination des produits chimiques. Washington: NationalAacademy Press.
- Société royale de chimie. (2015). hydrure de calcium ID 94784. Récupéré de chemspider.com: chemspider.com.
- Centre UC pour la sécurité des laboratoires. (2013, 18 janvier). mode opératoire standard hydrure de calcium. Récupéré de chemengr.ucsb.edu: chemengr.ucsb.edu.


Personne n'a encore commenté ce post.