
Molécules apolaires caractéristiques, identification et exemples
le molécules apolaires sont ceux qui présentent dans leur structure une distribution symétrique de leurs électrons. Ceci est possible si la différence d'électronégativité de leurs atomes est faible, ou si les atomes ou groupes électronégatifs annulent de manière vectorielle leurs effets sur la molécule..
L '«apolarité» n'est pas toujours absolue. Pour cette raison, les molécules à faible polarité sont parfois considérées comme apolaires; c'est-à-dire qu'il a un moment dipolaire µ proche de 0. Ici, nous entrons dans le champ du relatif: à quel point µ doit-il être bas pour qu'une molécule ou un composé soit considéré comme non polaire??
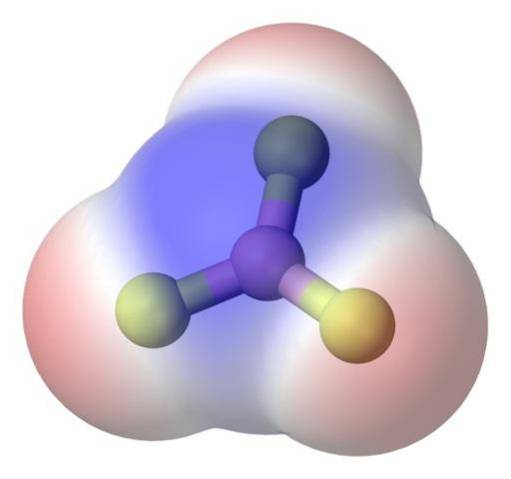
Pour mieux aborder le problème, il y a la molécule de trifluorure de bore, BF3 (image du haut).
L'atome de fluor est beaucoup plus électronégatif que l'atome de bore et, par conséquent, les liaisons B-F sont polaires. Cependant, la molécule BF3 est symétrique (plan trigonal) et implique l'annulation vectorielle des trois moments B-F.
Ainsi, des molécules apolaires sont également générées, même avec l'existence de liaisons polaires. La polarité générée peut être équilibrée par l'existence d'une autre liaison polaire, de même grandeur que la précédente, mais orientée dans le sens opposé; comme ça se passe dans le BF3.
Index des articles
- 1 Caractéristiques d'une molécule apolaire
- 1.1 Symétrie
- 1.2 Electronégativité
- 1.3 Forces intermoléculaires
- 2 Comment les identifier?
- 3 exemples
- 3.1 Gaz nobles
- 3.2 Molécules diatomiques
- 3.3 Hydrocarbures
- 3.4 Autres
- 4 Références
Caractéristiques d'une molécule apolaire
Symétrie
Pour que les effets des liaisons polaires s'annulent, la molécule doit avoir une certaine structure géométrique; par exemple linéaire, le plus simple à comprendre au premier coup d'œil.
C'est le cas du dioxyde de carbone (COdeux), qui a deux liaisons polaires (O = C = O). En effet, les deux moments dipolaires des liaisons C = O s'annulent lorsque l'un est orienté vers un côté, et le second vers l'autre, à un angle de 180 °..
Par conséquent, l'une des premières caractéristiques à prendre en compte lors de l'évaluation de «l'apolarité» d'une molécule à vol d'oiseau est d'observer sa symétrie..
Supposons qu'au lieu de COdeux nous avons la molécule COS (O = C = S), appelée sulfure de carbonyle.
Or, ce n'est plus une molécule apolaire, puisque l'électronégativité du soufre est inférieure à celle de l'oxygène; et par conséquent, le moment dipolaire C = S est différent de celui de C = O. En conséquence, COS est une molécule polaire (la polarité est une autre question).
L'image ci-dessous résume graphiquement tout ce qui vient d'être décrit:
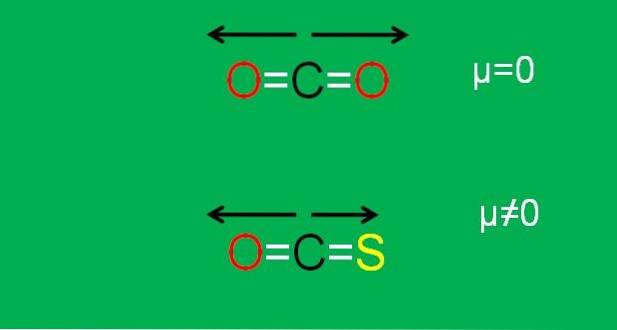
Notez que le moment dipolaire de la liaison C = S est inférieur à celui de la liaison C = O dans la molécule COS.
Électronégativité
L'électronégativité sur l'échelle de Pauling a des valeurs comprises entre 0,65 (pour le francium) et 4,0 (pour le fluor). En général, les halogènes ont une électronégativité élevée.
Lorsque la différence d'électronégativité des éléments formant une liaison covalente est inférieure ou égale à 0,4, on dit qu'elle est non polaire ou non polaire. Cependant, les seules molécules véritablement apolaires sont celles formées par des liaisons entre des atomes identiques (comme l'hydrogène, H-H)..
Forces intermoléculaires
Pour qu'une substance se dissolve dans l'eau, elle doit interagir électrostatiquement avec les molécules; interactions que les molécules apolaires ne peuvent pas effectuer.
Dans les molécules apolaires, leurs charges électriques ne sont pas confinées à une extrémité de la molécule, mais sont distribuées symétriquement (ou de manière homogène). Par conséquent, il est incapable d'interagir par les forces dipôle-dipôle.
Au lieu de cela, les molécules apolaires interagissent les unes avec les autres grâce aux forces de diffusion de Londres; Ce sont des dipôles instantanés qui polarisent le nuage électronique des atomes des molécules voisines. Ici, la masse moléculaire est un facteur prédominant dans les propriétés physiques de ces molécules..
Comment les identifier?
-L'une des meilleures méthodes pour identifier une molécule apolaire est peut-être sa solubilité dans différents solvants polaires, qui y sont généralement peu solubles..
-En général, les molécules apolaires sont de nature gazeuse. Ils peuvent également être de former des liquides non miscibles avec de l'eau.
-Les solides non polaires se caractérisent par leur douceur.
-Les forces de dispersion qui les maintiennent ensemble sont généralement faibles. De ce fait, leurs points de fusion ou d'ébullition ont tendance à être inférieurs à ceux des composés de nature polaire..
-Les molécules non polaires, en particulier sous forme liquide, sont de mauvais conducteurs d'électricité, car elles n'ont pas de charge électrique nette..
Exemples
gaz nobles
Bien qu'ils ne soient pas des molécules, les gaz nobles sont considérés comme apolaires. Si l'on suppose que deux de ses atomes, He-He, interagissent pendant de courtes périodes de temps, ladite interaction pourrait être considérée (pour moitié) comme une molécule; molécule qui serait de nature apolaire.
Molécules diatomiques
Molécules diatomiques, telles que Hdeux, Le BRdeux, le jedeux, le CLdeux, le Odeux, et le Fdeux, ils sont apolaires. Ceux-ci ont la formule générale Adeux, A-A.
Hydrocarbures
Et si A était un groupe d'atomes? Ce serait avant les autres composés apolaires; par exemple, éthane, CH3-CH3, dont le squelette carboné est linéaire, C-C.
Méthane, CH4, et éthane, CdeuxH6, ce sont des molécules apolaires. Le carbone a une électronégativité de 2,55; tandis que l'électronégativité de l'hydrogène est de 2,2. Il existe donc un vecteur dipôle de faible intensité, orienté de l'hydrogène vers le carbone..
Mais, en raison de la symétrie géométrique des molécules de méthane et d'éthane, la somme des vecteurs dipolaires ou des moments dipolaires dans leurs molécules est nulle, il n'y a donc pas de charge nette sur les molécules..
En général, la même chose se produit avec tous les hydrocarbures, et même lorsqu'ils contiennent des insaturations (doubles et triples liaisons), ils sont considérés comme des composés non polaires ou de faible polarité. De plus, les hydrocarbures cycliques sont des molécules apolaires, telles que le cyclohexane ou le cyclobutane.
Autres
Molécules de dioxyde de carbone (COdeux) et le disulfure de carbone (CSdeux) sont des molécules apolaires, toutes deux à géométrie linéaire.
Dans le disulfure de carbone, l'électronégativité du carbone est de 2,55, tandis que l'électronégativité du soufre est de 2,58; donc les deux éléments ont pratiquement la même électronégativité. Il n'y a pas de génération d'un vecteur dipôle et donc la charge nette est nulle.
De même, nous avons les molécules CCl suivantes4 et AlBr3, les deux apolaires:
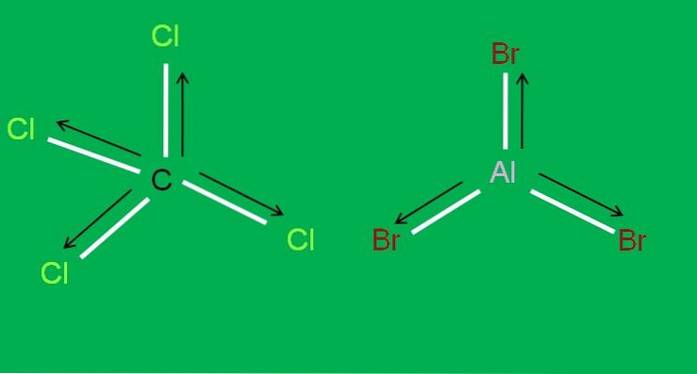
En tribromure d'aluminium, AlBr3 la même chose se passe avec le BF3, au début de l'article. Pendant ce temps, pour le tétrachlorure de carbone, CCl4, la géométrie est tétraédrique et symétrique, puisque toutes les liaisons C-Cl sont égales.
De même, les molécules de formule générale CX4 (CF4, CI4 et CBr4), ils sont également apolaires.
Et enfin, une molécule apolaire peut même avoir une géométrie octaédrique, comme c'est le cas avec l'hexafluorure de soufre, SF6. En fait, il peut avoir n'importe quelle géométrie ou structure, du moment qu'il est symétrique et que sa distribution électronique est homogène..
Les références
- Carey F. A. (2008). Chimie organique. Acides carboxyliques. (Sixième édition). Mc Graw Hill.
- Cedrón J., Landa V., Robles J. (2011). Polarité moléculaire. Récupéré de: corinto.pucp.edu.pe
- Vue du tuteur. (2018). Molécule non polaire. Récupéré de: chemistry.tutorvista.com
- Helmenstine, Anne Marie, Ph.D. (28 janvier 2019). Exemples de molécules polaires et non polaires. Récupéré de: thinkco.com
- Kurtus R. (19 septembre 2016). Molécules polaires et non polaires. École des champions. Récupéré de: school-for-champions.com
- Ganong W. (2004). Physiologie médicale. Numéro 19E. Éditorial du manuel moderne.

Personne n'a encore commenté ce post.