
Étapes de la méthode d'équilibrage Redox, exemples, exercices
le méthode d'équilibrage redox C'est celui qui permet d'équilibrer les équations chimiques des réactions redox, ce qui serait autrement un casse-tête. Ici, une ou plusieurs espèces échangent des électrons; celui qui en fait don ou qui les perd s'appelle l'espèce oxydante, tandis que celui qui les accepte ou les acquiert, l'espèce réductrice.
Dans cette méthode, il est essentiel de connaître les nombres d'oxydation de ces espèces, car ils révèlent combien d'électrons ils ont gagné ou perdu par mole. Grâce à cela, il est possible d'équilibrer les charges électriques en écrivant les électrons dans les équations comme s'il s'agissait de réactifs ou de produits..
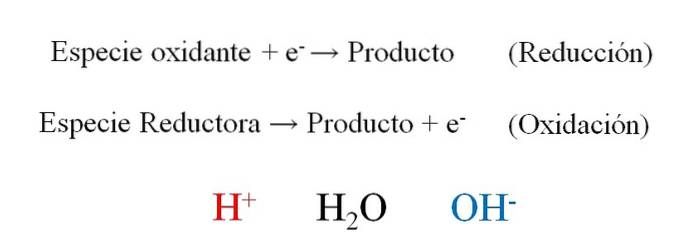
L'image ci-dessus montre l'efficacité des électrons, et- ils sont placés comme réactifs lorsque l'espèce oxydante les gagne; et comme produits lorsque l'espèce réductrice les perd. Notez que pour équilibrer ces types d'équations, il est nécessaire de maîtriser les notions d'oxydation et de nombres d'oxydo-réduction..
L'espèce H+, HdeuxO et OH-, En fonction du pH du milieu réactionnel, il permet un équilibrage redox, c'est pourquoi il est très fréquent de les retrouver dans les exercices. Si le milieu est acide, on se tourne vers le H+; mais si au contraire le médium est basique, alors on utilise l'OH- pour se balancer.
La nature de la réaction elle-même dicte le pH du milieu. C'est pourquoi, bien qu'elle puisse être équilibrée en supposant un milieu acide ou basique, l'équation équilibrée finale indiquera si les ions H sont vraiment dispensables ou non.+ et OH-.
Index des articles
- 1 étapes
- 1.1 - Général
- 1.2 - Équilibrage en milieu acide
- 1.3 - Equilibrage en milieu de base
- 2 exemples
- 3 exercices
- 3.1 Exercice 1
- 3.2 Exercice 2
- 4 Références
Pas
- Général
Vérifiez les nombres d'oxydation des réactifs et des produits
Supposons l'équation chimique suivante:
Cu (s) + AgNO3(ac) → Cu (NON3)deux + Ag (s)
Cela correspond à une réaction redox, dans laquelle un changement se produit dans les nombres d'oxydation des réactifs:
Cu0(s) + Ag+NE PAS3(ac) → Cudeux+(NE PAS3)deux + Ag (s)0
Identifier les espèces oxydantes et réductrices
L'espèce oxydante gagne des électrons en oxydant l'espèce réductrice. Par conséquent, son nombre d'oxydation diminue: il devient moins positif. Pendant ce temps, le nombre d'oxydation de l'espèce réductrice augmente, car il perd des électrons: il devient plus positif..
Ainsi, dans la réaction précédente, le cuivre est oxydé, car il passe de Cu0 à Cudeux+; et l'argent est réduit, car il passe d'Ag+ à Ag0. Le cuivre est l'espèce réductrice et l'argent l'espèce oxydante.
Ecrire les demi-réactions et équilibrer les atomes et les charges
Identifiant quelles espèces gagnent ou perdent des électrons, les demi-réactions redox sont écrites pour les réactions de réduction et d'oxydation:
Cu0 → Cudeux+
Ag+ → Ag0
Le cuivre perd deux électrons, tandis que l'argent en gagne un. Nous plaçons les électrons dans les deux demi-réactions:
Cu0 → Cudeux+ + 2e-
Ag+ + et- → Ag0
Notez que les charges restent équilibrées dans les deux demi-réactions; mais s'ils étaient additionnés, la loi de conservation de la matière serait violée: le nombre d'électrons doit être égal dans les deux demi-réactions. Par conséquent, la deuxième équation est multipliée par 2 et les deux équations sont ajoutées:
(Cu0 → Cudeux+ + 2e-) x 1
(Ag+ + et- → Ag0) x 2
Cu0 + 2Ag+ + 2e- → Cudeux+ + 2Ag0 + 2e-
Les électrons s'annulent car ils sont sur les côtés des réactifs et des produits:
Cu0 + 2Ag+ → Cudeux+ + 2Ag0
C'est l'équation ionique globale.
Remplacez les coefficients de l'équation ionique par l'équation générale
Enfin, les coefficients stoechiométriques de l'équation précédente sont transférés dans la première équation:
Cu (s) + 2AgNO3(ac) → Cu (NON3)deux + 2Ag (s)
Notez que 2 était positionné avec AgNO3 car dans ce sel l'argent est comme Ag+, et la même chose se produit avec Cu (NON3)deux. Si cette équation n'est pas équilibrée à la fin, nous procédons à l'essai.
L'équation proposée dans les étapes précédentes aurait pu être équilibrée directement par essais et erreurs. Cependant, il existe des réactions redox qui nécessitent un milieu acide (H+) ou basique (OH-) avoir lieu. Lorsque cela se produit, il ne peut pas être équilibré en supposant que le milieu est neutre; comme juste montré (pas de H+ et ni OH-).
D'autre part, il est commode de savoir que les atomes, ions ou composés (principalement des oxydes) dans lesquels se produisent les changements des nombres d'oxydation sont écrits dans les demi-réactions. Cela sera mis en évidence dans la section des exercices.
- Équilibre en milieu acide
Lorsque le milieu est acide, il faut s'arrêter aux deux demi-réactions. Cette fois, lors de l'équilibrage, nous ignorons les atomes d'oxygène et d'hydrogène, ainsi que les électrons. Les électrons s'équilibreront à la fin.
Ensuite, du côté de la réaction avec moins d'atomes d'oxygène, on ajoute des molécules d'eau pour la compenser. De l'autre côté, nous équilibrons les hydrogènes avec des ions H+. Et enfin, nous ajoutons les électrons et procédons en suivant les étapes générales déjà décrites..
- Équilibre en milieu de base
Lorsque le milieu est basique, on procède de la même manière que dans le milieu acide avec une petite différence: cette fois du côté où il y a plus d'oxygène, se situeront un nombre de molécules d'eau égal à cet excès d'oxygène; et de l'autre côté, les ions OH- pour compenser les hydrogènes.
Enfin, les électrons sont équilibrés, les deux demi-réactions sont ajoutées et les coefficients de l'équation ionique globale sont substitués dans l'équation générale.
Exemples
Les équations redox équilibrées et déséquilibrées suivantes servent d'exemples pour voir combien elles changent après l'application de cette méthode d'équilibrage:
P4 + ClO- → PO43- + Cl- (déséquilibré)
P4 + 10 ClO- + 6 heuresdeuxO → 4 PO43- + 10 cl- + 12 heures+ (milieu acide équilibré)
P4 + 10 ClO- + 12 OH- → 4 PO43- + 10 cl- + 6 heuresdeuxO (médium équilibré basique)
jedeux + KNO3 → je- + KIO3 + NE PAS3- (déséquilibré)
3Ideux + KNO3 + 3HdeuxO → 5I- + KIO3 + NE PAS3- + 6H+ (milieu acide équilibré)
CrdeuxOU ALORSdeux7- + HNOdeux → Cr3+ + NE PAS3- (déséquilibré)
3HNOdeux + 5H+ + CrdeuxOU ALORSdeux7- → 3NON3- +2Cr3+ + 4HdeuxO (milieu acide équilibré)
Exercices
Exercice 1
Équilibrez l'équation suivante en milieu de base:
jedeux + KNO3 → je- + KIO3 + NE PAS3-
Etapes générales
Nous commençons par écrire les nombres d'oxydation des espèces que nous soupçonnons d'avoir été oxydées ou réduites; dans ce cas, les atomes d'iode:
jedeux0 + KNO3 → je- + KI5+OU ALORS3 + NE PAS3-
Notez que l'iode est oxydé et en même temps réduit, nous procédons donc à l'écriture de leurs deux demi-réactions respectives:
jedeux → je- (réduction, pour chaque je- 1 électron est consommé)
jedeux → IO3- (oxydation, pour chaque IO3- 5 électrons sont libérés)
Dans la demi-réaction d'oxydation, nous plaçons l'anion IO3-, et pas l'atome d'iode comme moi5+. Nous équilibrons les atomes d'iode:
jedeux → 2I-
jedeux → 2IO3-
Équilibre en milieu de base
Maintenant, nous nous concentrons sur l'équilibrage de la semi-réaction d'oxydation en milieu basique, car il a une espèce oxygénée. On ajoute côté produit le même nombre de molécules d'eau qu'il y a d'atomes d'oxygène:
jedeux → 2IO3- + 6HdeuxOU ALORS
Et sur le côté gauche, nous équilibrons les hydrogènes avec OH-:
jedeux + 12OH- → 2IO3- + 6HdeuxOU ALORS
Nous écrivons les deux demi-réactions et ajoutons les électrons manquants pour équilibrer les charges négatives:
jedeux + 2e- → 2I-
jedeux + 12OH- → 2IO3- + 6HdeuxO + 10e-
Nous égalisons les nombres d'électrons dans les deux demi-réactions et les ajoutons:
(JEdeux + 2e- → 2I-) x 10
(JEdeux + 12OH- → 2IO3- + 6HdeuxO + 10e-) x 2
12Ideux + 24 OH- + 20e- → 20I- + 4IO3- + 12HdeuxO + 20e-
Les électrons s'annulent et nous divisons tous les coefficients par quatre pour simplifier l'équation ionique globale:
(12Ideux + 24 OH- → 20I- + 4IO3- + 12HdeuxO) x ¼
3Ideux + 6OH- → 5I- + IO3- + 3HdeuxOU ALORS
Et enfin, nous substituons les coefficients de l'équation ionique dans la première équation:
3Ideux + 6OH- + KNO3 → 5I- + KIO3 + NE PAS3- + 3HdeuxOU ALORS
L'équation est déjà équilibrée. Comparez ce résultat avec l'équilibrage en milieu acide de l'exemple 2.
Exercice 2
Équilibrez l'équation suivante en milieu acide:
FoideuxOU ALORS3 + CO → Fe + COdeux
Etapes générales
Nous examinons les nombres d'oxydation du fer et du carbone pour savoir lequel des deux a été oxydé ou réduit:
Foideux3+OU ALORS3 + Cdeux+O → Foi0 + C4+OU ALORSdeux
Le fer a été réduit, ce qui en fait l'espèce oxydante. Pendant ce temps, le carbone s'est oxydé, se comportant comme l'espèce réductrice. Les demi-réactions d'oxydation et de réduction concernées sont:
Foideux3+OU ALORS3 → Foi0 (réduction, pour chaque Fe 3 électrons sont consommés)
CO → COdeux (oxydation, pour chaque COdeux 2 électrons sont libérés)
Notez que nous écrivons l'oxyde, FedeuxOU ALORS3, parce qu'il contient la foi3+, au lieu de simplement placer le Fe3+. Nous équilibrons les atomes nécessaires sauf ceux d'oxygène:
FoideuxOU ALORS3 → 2Fe
CO → COdeux
Et nous procédons à l'équilibrage en milieu acide dans les deux demi-réactions, car il y a des espèces oxygénées entre les deux..
Équilibre en milieu acide
Nous ajoutons de l'eau pour équilibrer les oxygènes, puis H+ pour équilibrer les hydrogènes:
FoideuxOU ALORS3 → 2Fe + 3HdeuxOU ALORS
6H+ + FoideuxOU ALORS3 → 2Fe + 3HdeuxOU ALORS
CO + HdeuxO → COdeux
CO + HdeuxO → COdeux + 2H+
Maintenant, nous équilibrons les charges en plaçant les électrons impliqués dans les demi-réactions:
6H+ + 6e- + FoideuxOU ALORS3 → 2Fe + 3HdeuxOU ALORS
CO + HdeuxO → COdeux + 2H+ + 2e-
Nous égalisons le nombre d'électrons dans les deux demi-réactions et les ajoutons:
(6H+ + 6e- + FoideuxOU ALORS3 → 2Fe + 3HdeuxO) x 2
(CO + HdeuxO → COdeux + 2H+ + 2e-) x 6
12 heures+ + 12e- + 2FedeuxOU ALORS3 + 6CO + 6HdeuxO → 4Fe + 6HdeuxO + 6COdeux + 12H+ + 12e-
On annule les électrons, les ions H+ et les molécules d'eau:
2FedeuxOU ALORS3 + 6CO → 4Fe + 6COdeux
Mais ces coefficients peuvent être divisés par deux pour simplifier encore plus l'équation, ayant:
FoideuxOU ALORS3 + 3CO → 2Fe + 3COdeux
Cette question se pose: l'équilibrage redox était-il nécessaire pour cette équation? Par essais et erreurs, cela aurait été beaucoup plus rapide. Cela montre que cette réaction se déroule quel que soit le pH du milieu..
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (22 septembre 2019). Comment équilibrer les réactions redox. Récupéré de: thinkco.com
- Ann Nguyen et Luvleen Brar. (05 juin 2019). Équilibrer les réactions redox. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Quimitube. (2012). Exercice 19: Ajustement d'une réaction redox en milieu basique avec deux demi-réactions d'oxydation. Récupéré de: quimitube.com
- Université de Washington à Saint-Louis. (s.f.). Problèmes de pratique: réactions redox. Récupéré de: chemistry.wustl.edu
- John Wiley et fils. (2020). Comment équilibrer les équations redox. Récupéré de: dummies.com
- Rubén Darío O. G. (2015). Équilibrer les équations chimiques. Récupéré de: aprendeenlinea.udea.edu.co


Personne n'a encore commenté ce post.