
Historique des non-métaux, propriétés, groupes, utilisations
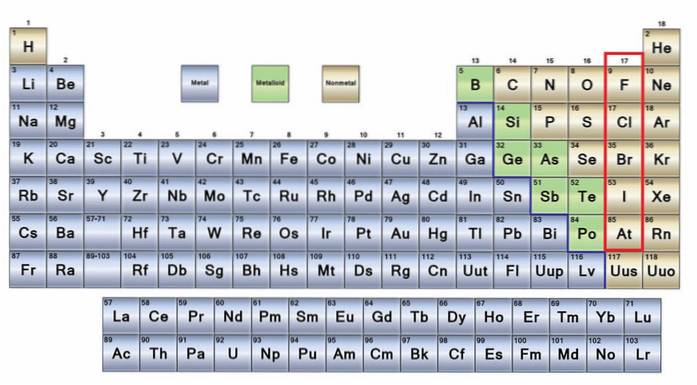
Les pas de métaux Il s'agit d'un groupe d'éléments situés sur le côté droit du tableau périodique, à l'exception de l'hydrogène situé dans le groupe 1 (IA), avec les métaux alcalins. Si vous voulez savoir ce qu'ils sont, vous devez regarder le coin supérieur droit du bloc p.
Les atomes non métalliques sont relativement petits et leur enveloppe électronique externe contient un nombre élevé d'électrons. Parmi les éléments non métalliques peuvent être des solides, des liquides et des gaz; bien que la plupart soient à l'état gazeux, plusieurs d'entre eux enrichissent l'atmosphère.
Une bonne partie des non-métaux est présente dans tous les êtres vivants sous forme de composés et de macromolécules. Par exemple: le carbone, l'oxygène et l'hydrogène sont présents dans toutes les protéines, lipides, glucides et acides nucléiques.
Le phosphore est présent dans tous les acides nucléiques et dans certains glucides et lipides. Le soufre se trouve dans de nombreuses protéines. L'azote fait partie de tous les acides nucléiques et protéines.
En revanche, les gaz souterrains, le méthane et le pétrole brut sont presque entièrement composés d'éléments non métalliques. En fait, les hydrocarbures (carbone et hydrogène) donnent une idée de l'abondance des non-métaux malgré leur plus petit nombre d'éléments dans le tableau périodique..
Index des articles
- 1 Histoire
- 2 Propriétés physiques et chimiques
- 2.1 Physique
- 2.2 Chimie
- 3 Groupes de non-métaux et éléments
- 3.1 Groupe 1
- 3.2 Groupe 14
- 3.3 Groupe 15
- 3.4 Groupe 16
- 3.5 Groupe 17
- 3.6 Groupe 18
- 4 utilisations
- 4.1 Hydrogène
- 4.2 Carbone
- 4.3 Azote
- 4.4 Phosphore
- 4.5 Oxygène
- 4.6 Soufre
- 4.7 Sélénium
- 4.8 Fluor
- 4.9 Chlore
- 4.10 Brome
- 4.11 Iode
- 4.12 Hélium
- 4.13 Néon
- 4.14 Argon
- 4.15 Xénon
- 4.16 Radon
- 5 Références
Histoire
Depuis l'Antiquité (3750 av.J.-C.), les Égyptiens utilisaient le charbon pour réduire le cuivre présent dans leurs minéraux, tels que la corvellite et la malachite.
En 1669, Hennin Brand réussit à isoler le phosphore de l'urine collectée. Henry Cavendish (1776) a réussi à identifier l'hydrogène, bien que plusieurs chercheurs, dont Robert Boyle (1670), aient produit de l'hydrogène en faisant réagir un acide fort avec un métal.
Carl Scheele a produit de l'oxygène en chauffant de l'oxyde de mercure avec des nitrates (1771). Curtois a réussi à isoler l'iode, tout en essayant de préparer du salpêtre à partir d'algues (1811). Brome isolé Balard et Gmelin (1825).
En 1868, Janssen et Lockger ont découvert indépendamment l'hélium en observant une ligne jaune dans l'étude du spectre de la lumière du soleil qui n'appartenait pas à un autre élément. Moissan a réussi à isoler le fluorure (1886).
En 1894, Lord Rayleigh et Ramsey ont découvert l'argon en étudiant les propriétés de l'azote. Ramsay et Travers (1898) ont isolé le krypton, le néon et le xénon de l'argon liquide par distillation cryogénique de l'air..
Proprietes physiques et chimiques

Physique
Certaines des propriétés physiques des non-métaux sont:
-Ils ont une faible conductance électrique, à l'exception du carbone sous forme de graphite, qui est un bon conducteur d'électricité..
-Ils peuvent apparaître sous l'aspect physique de solides, liquides ou gaz.
-Ils ont une faible conductance thermique, sauf pour le carbone sous forme de diamant, qui ne se comporte pas comme un isolant thermique..
-Ils ont un faible lustre, contrairement au lustre métallique des métaux.
-Les solides non métalliques sont cassants, ils ne sont donc ni ductiles ni malléables.
-Ils ont des points de fusion et d'ébullition bas.
-Ils peuvent avoir différentes structures cristallines. Ainsi, le phosphore, l'oxygène et le fluor ont une structure cristalline cubique; hydrogène, carbone et azote, hexagonal; et soufre, chlore, brome et iode, orthorhombique.
Chimie
Les non-métaux se caractérisent par une énergie d'ionisation élevée et une valeur d'électronégativité élevée. Le fluor, par exemple, a la plus haute électronégativité (3,98), étant l'élément le plus réactif des non-métaux.
Mais étonnamment, les gaz rares hélium (5,5) et néon (4,84) ont l'électronégativité la plus élevée. Cependant, ils sont chimiquement inertes car les coques électroniques externes sont remplies..
Les non-métaux forment des composés ioniques avec les métaux et covalents avec les non-métaux.
On trouve des éléments non métalliques formant des molécules diatomiques, liées par des liaisons covalentes. Pendant ce temps, les atomes de gaz rares se présentent sous la forme d'unités atomiques.
Ils forment des oxydes acides qui, lorsqu'ils réagissent avec l'eau, donnent naissance à des acides.
Groupes et éléments non métalliques
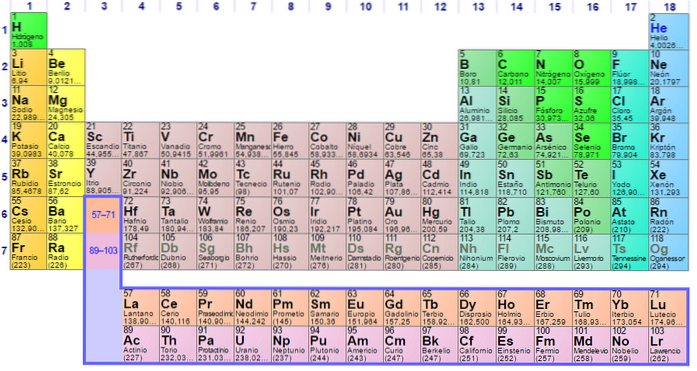
Groupe 1
Il est composé d'hydrogène, un gaz incolore et inodore, diatomique. État d'oxydation +1. Il a une densité inférieure à celle de l'air. À l'état solide, il a une structure cristalline hexagonale. L'hydrogène est un élément peu réactif.
Groupe 14
Le carbone est le seul non-métal de ce groupe. Le carbone sous forme de graphite est un solide brillant, avec une structure cristalline hexagonale. Il a une conductivité électrique élevée. Ses états d'oxydation les plus courants sont +2 et +4.
Groupe 15
Azote
Gaz incolore et inodore. C'est un élément légèrement réactif et légèrement plus dense que l'air. États d'oxydation les plus courants: -3 et +5. Forme des molécules diatomiques, Ndeux.
Correspondre
Solide, sa couleur peut être blanche, jaune ou noire. Peu réactif. Structure cristalline orthorhombique. Electronégativité 2.1. États d'oxydation les plus courants: -3 et +5.
Groupe 16
Oxygène
Gaz incolore ou bleu pâle, inodore. Généralement non réactif. Structure cristalline cubique. C'est un isolant et un oxydant puissant. Electronégativité 3.5. État d'oxydation -2
Soufre
Solide jaune brillant, cassant, modérément réactif. Structure cristalline orthorhombique. Forme des liaisons covalentes. Electronégativité 2.5. États d'oxydation les plus courants: -2, +2, +4 et +6.
Sélénium
Gris uni ou rougeâtre à noir. Le sélénium gris présente une conductivité électrique sensible à la lumière. C'est un solide mou et cassant. Electronégativité 2.4. États d'oxydation: -2, +2, +4 et +6.
Groupe 17
Fluor
C'est un gaz jaune pâle, très toxique. C'est un élément très réactif. Il se produit sous forme de molécules diatomiques, Fdeux. À l'état solide, il cristallise sous forme cubique. Électronégativité 3.98. États d'oxydation -1.
Chlore
C'est un gaz vert-jaune. Il présente des molécules diatomiques, Cldeux. C'est très réactif. A l'état solide, la structure cristalline est orthorhombique. Électronégativité 3.0. États d'oxydation: - 1, +1, +3, +5, +7.
Brome
C'est un liquide rouge-brun. Electronégativité 2.8. États d'oxydation -1, +1, +3, +5 et +7.
Iode
C'est un solide noir qui, lorsqu'il est sublimé, émet une vapeur violette. Structure cristalline orthorhombique. Les iodures métalliques sont ioniques. Electronégativité 2.5. États d'oxydation: -1, +1, +3, +5 et +7.
Astatus
C'est un noir uni. Structure cristalline cubique centrée sur la face. Electronégativité 2.2. C'est un agent oxydant faible.
Groupe 18
Hélium
Il a une conductivité thermique élevée. Electronégativité 5.5. Il est chimiquement inerte et ininflammable. Faible densité et grande fluidité.
Néon
Capacité de refroidissement élevée à l'état liquide. Electronégativité 4.84. C'est le moins réactif des gaz rares.
Argon
C'est plus dense que l'air. Chimiquement inerte. Électronégativité 3.2.
Krypton
Électronégativité 2.94. Peut réagir avec le fluor pour former du difluorure de krypton (KrFdeux).
Xénon
Il traverse la barrière hémato-encéphalique. Il répond au courant électrique en produisant de la lumière. Electronégativité 2.2. Forme des complexes avec le fluor, l'or et l'oxygène.
Radon
C'est un élément radioactif. Électronégativité 2.06. Forme des composés avec du fluor (RnFdeux) et avec de l'oxygène (RnO3).
Applications
Hydrogène
Il est utilisé dans la propulsion des fusées et comme carburant dans les moteurs de voitures utilisant de l'hydrogène. Il est utilisé dans la synthèse de l'ammoniac (NH3) et dans l'hydrogénation des graisses.
Carbone

Le graphite est utilisé dans la fabrication de crayons et de fibres à haute résistance qui sont utilisés dans la fabrication d'articles de sport. Le diamant est utilisé comme bijou de grande valeur et dans les trous de forage comme abrasif. Le dioxyde de carbone est utilisé dans la production de boissons gazeuses.
Azote
Il est utilisé dans la production d'ammoniac, d'acide nitrique et d'urée. L'azote est un élément essentiel pour les plantes et est utilisé dans la fabrication d'engrais.
Correspondre
Le phosphore blanc est utilisé comme rodenticide, insecticide et dans l'industrie des feux d'artifice. Le phosphore rouge est utilisé pour faire des allumettes. Ses composés sont également utilisés dans la production d'engrais.
Oxygène
L'oxygène est utilisé dans la fabrication de l'acier, des plastiques et des textiles. Il est également utilisé dans les propulseurs de fusée, l'oxygénothérapie et l'assistance respiratoire dans les avions, les sous-marins et les vols spatiaux..
Soufre
Il est utilisé comme matière première pour la production d'acide sulfurique, de poudre à canon et dans la vulcanisation des caoutchoucs. Les sulfites sont utilisés pour blanchir le papier et dans les fongicides.
Sélénium
Il est utilisé pour donner une teinte rouge écarlate au verre. Il est également utilisé pour neutraliser la teinte verdâtre produite par la contamination du verre par des composés de fer. Il est utilisé dans les cellules photoélectriques avec une application dans les portes et les ascenseurs.
Fluor

Il est ajouté aux dentifrices pour éviter les caries. Le fluorure d'hydrogène est utilisé comme matière première pour le téflon. Le fluor monatomique est utilisé dans la fabrication de semi-conducteurs.
Chlore
Il est utilisé dans la métallurgie extractive et dans la chloration des hydrocarbures pour la fabrication de divers produits comme le PVC. Le chlore est utilisé dans la pâte de bois et les agents de blanchiment textiles. Il est également utilisé comme désinfectant de l'eau.
Brome
Il est utilisé dans la préparation du bromure d'argent pour les lentilles sensibles à la lumière et dans les films photographiques.Il est également utilisé dans la fabrication du bromure de sodium sédatif et du dibrométhane, un composant anti-cliquetis de l'essence.
Iode
De l'iodure de potassium (KI) est ajouté pour empêcher le goitre thyroïdien. La teinture d'iode est utilisée comme antiseptique et germicide. L'iode fait partie des hormones thyroïdiennes.
Hélium
Il est utilisé dans le remplissage des ballons à air chaud et mélangé à de l'oxygène pour la respiration en eau profonde. Il est utilisé pour le soudage dans une atmosphère inerte, et aide également à maintenir des températures très basses dans la recherche.
Néon
Dans des tubes de verre éclairés par l'action de l'électricité (néons rouges).
Argon
Utilisé pour créer une atmosphère de soudage et lors du remplissage d'ampoules à incandescence.
Xénon
Un mélange de xénon et de krypton est utilisé dans la production de flashs de haute intensité lors de courtes expositions photographiques.
Radon
Il est utilisé dans le traitement des tumeurs cancéreuses par radiothérapie.
Les références
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. et Ahern, K. G. (2002). Biochimie. Troisième édition. Éditer. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06 octobre 2019). Quelles sont les propriétés des non-métaux? Récupéré de: thinkco.com
- Wikipédia. (2019). Non métallique. Récupéré de: en.wikipedia.org
- Les rédacteurs de l'Encyclopaedia Britannica. (5 avril 2016). Non métallique. Encyclopædia Britannica. Récupéré de: britannica.com
- José M. Gavira Vallejo. (2016, 27 janvier). Quels sont les éléments polygéniques? Et les icosagens, les cristallógens, les chalcogènes ...? Récupéré de: triplenlace.com


Personne n'a encore commenté ce post.