
Classification des systèmes de matériaux, phases et exemples
Les systèmes de matériaux Ce sont tous ceux qui sont composés de matière et qui sont isolés du reste de l'univers à étudier. La matière est partout, donnant forme et sens réel aux perceptions de la vie quotidienne, mais quand on veut étudier une partie de la matière, son environnement est méprisé et on parle d'un système matériel..
Ils sont très variables, car il existe des matériaux purs et composites, ainsi que différents états et phases d'agrégations. Comment définir la frontière entre le système matériel et son environnement? Tout dépend des variables considérées. Par exemple, dans l'image ci-dessous, chaque bonbon pourrait être le système à l'étude..

Cependant, si la variable de couleur doit être prise en compte, alors il est nécessaire de considérer toutes les billes dans le distributeur automatique. Parce que la machine n'a pas d'intérêt, c'est l'environnement des billes. Ainsi, le système matériel de l'exemple en vient à être la masse des billes et leurs propriétés (qu'il s'agisse de chewing-gum, de menthe, etc.).
Cependant, chimiquement, les systèmes de matériaux sont définis comme toute substance pure ou un mélange de celles-ci, classés selon leurs aspects physiques..
Index des articles
- 1 Classement
- 1.1 Système de matériau homogène
- 1.2 Système de matériaux hétérogènes
- 2 phases
- 2.1 Diagramme de phase
- 3 exemples
- 4 Références
Classification
Système de matériau homogène
La matière étudiée peut présenter une apparence uniforme, dans laquelle ses propriétés restent constantes quel que soit l'échantillon analysé. En d'autres termes: ce type de système se caractérise par n'avoir qu'une seule phase de matière au premier coup d'œil.
Substance pure et composés
Si une substance pure est analysée, alors il sera constaté que les propriétés physico-chimiques coïncident dans les mêmes valeurs et résultats, même si de nombreux échantillons sont prélevés (et dans des zones géographiques différentes)..
Par exemple, si un échantillon de calcium était comparé à un échantillon d'Asie, d'Europe, d'Afrique et d'Amérique, ils auraient tous les mêmes propriétés. La même chose se produirait si un échantillon de carbone pur était prélevé.
D'autre part, un composé pur manifeste également ce qui est mentionné ci-dessus. S'il était garanti qu'une ardoise était faite d'un seul et unique matériau, alors elle serait classée comme un système de matériaux homogènes..
Cependant, cela ne se produit pas pour un échantillon minéral, car il contient en général des impuretés provenant d'autres minéraux associés, et dans ce cas, il s'agit d'un système de matériaux hétérogènes. De même, ces systèmes matériels tels que les arbres, les pierres, les montagnes ou les rivières entrent dans cette dernière classification..
Dissolution
Le vinaigre commercial est une solution aqueuse à 5% d'acide acétique; c'est-à-dire que 5 ml d'acide acétique pur sont dissous dans 100 ml d'eau. Cependant, son aspect est celui d'un liquide transparent, bien qu'en réalité il s'agisse de deux composés purs (eau et acide acétique) combinés.
Système de matériaux hétérogènes
Contrairement à l'homogène, dans cette classe de système ni l'aspect ni les propriétés ne sont constants, étant irréguliers dans toute son extension..
De plus, il peut être soumis à des techniques de séparation physique ou chimique, dont sont extraites des phases considérées chacune comme un système homogène..
Les phases
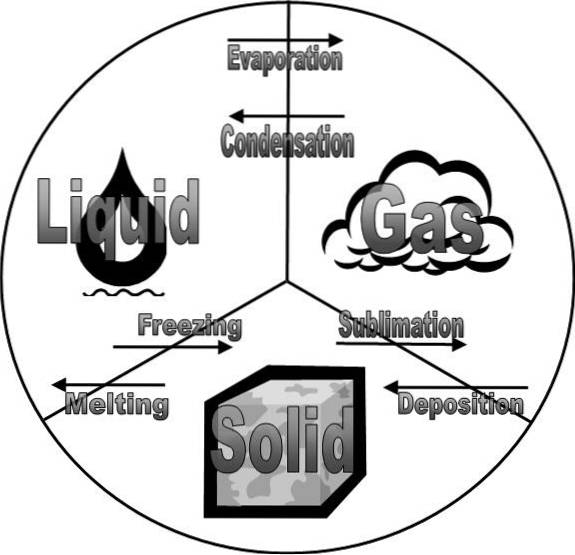
L'image du haut montre les états de la matière et leurs changements. Celles-ci sont étroitement liées aux phases de la matière car, bien qu'elles soient identiques, elles présentent des différences subtiles..
Ceci étant le cas, les phases d'un système matériel sont solides, liquides et gazeuses. En d'autres termes, pour certaines matières soumises à l'analyse, il peut adopter n'importe laquelle des phases précédentes.
Cependant, étant donné que les interactions dans les solides sont très fortes et qu'elles dépendent de variables telles que la pression et la température, un système peut ou non avoir des phases solides différentes..
Par exemple, le composé X, solide à température ambiante, a la phase I; mais lorsque la pression sur lui est très élevée, ses molécules se réarrangent de manière plus compacte, et alors une transition se produit de la phase I à la phase solide II..
Il existe même d'autres phases, telles que III et IV, qui dérivent de II à des températures différentes. Ainsi, le système matériel homogène de X d'une phase solide apparente peut acquérir jusqu'à quatre phases solides: I, II, III et IV.
Dans le cas des systèmes liquides et gazeux, généralement les molécules ne peuvent adopter qu'une seule phase dans ces états de la matière. En d'autres termes, il peut ne pas y avoir de phase gazeuse I et de phase gazeuse II..
Diagramme de phase
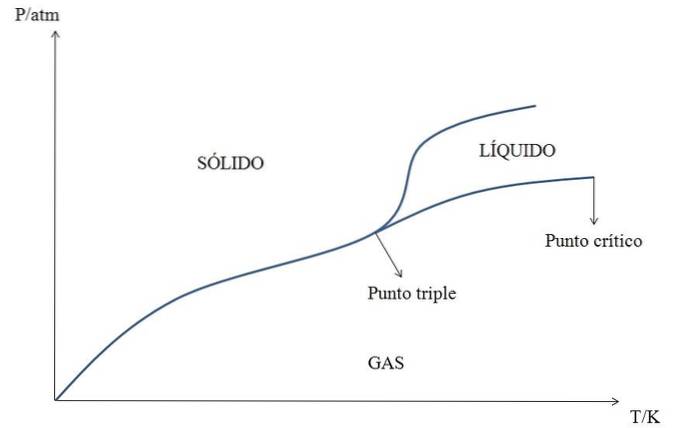
Il existe de nombreux diagrammes de phase: certains pour un seul composé ou substance (comme celui de l'image ci-dessus), et d'autres pour des systèmes binaires (un sel dans l'eau, par exemple) ou ternaires (trois composants).
Le plus «simple» de tous est le diagramme de phase d'une substance. Ainsi, pour la substance hypothétique Y, sa phase est représentée en fonction de la pression (axe y) et de la température (axe des abscisses).
À basse pression, c'est un gaz, quelle que soit sa température. Cependant, lors de l'augmentation de la pression Y, le gaz se dépose dans le solide Y.
Cependant, à des températures supérieures au point critique Y gazeux se condense en liquide Y, et si la pression est également augmentée (on monte verticalement à travers le diagramme), le liquide se solidifie.
Chaque ligne représente l'équilibre entre les deux phases qu'elle sépare: solide-gaz, liquide-gaz, solide-liquide, liquide-solide et solide-liquide-gaz au point triple.
De plus, à partir du point critique Y, aucune distinction physique n'est mise en évidence entre la phase gazeuse et la phase liquide: elle forme ce que l'on appelle le fluide supercritique..
Exemples

- Un ballon est un système matériel, car son contenu est gazeux et, par conséquent, a une nature chimique; si le gaz est moins dense que l'air, le ballon montera vers le ciel.
- Le système binaire eau-huile comporte deux phases: l'une d'eau et l'autre, logiquement, d'huile. L'ensemble des deux est le système hétérogène, tandis que les couches individuelles sont des systèmes homogènes. Si vous souhaitez extraire l'huile, vous devez effectuer une extraction liquide-liquide avec un solvant organique et volatil..
- Un système solide-solide peut être constitué d'un mélange de sucre blanc et de sucre brun. Ici, la différence de couleur entre les cristaux fait de ce boîtier un système hétérogène.
- L'eau de mer est un autre exemple de système de matériaux homogènes. Il se compose d'une solution de nombreux ions, responsables de son goût salé caractéristique. Si un échantillon d'eau de mer s'évapore dans un récipient, il y sédimentera des sels blancs..
Les références
- Un système et ses environs. Extrait le 27 mai 2018 de: chem.libretexts.org
- Antonio de Ulloa. Systèmes matériels. [PDF]. Extrait le 27 mai 2018 de: 2.educarchile.cl
- Daniel J. Berger. (2001). Récupéré le 27 mai 2018 de: bluffton.edu
- Le système et les environs en chimie. Récupéré le 27 mai 2018 de: chemteam.info
- Helmenstine, Anne Marie, Ph.D. (6 février 2018). Définition du système ouvert en chimie. Récupéré le 27 mai 2018 de: thinkco.com
- Centre de recherche Glen. Phases de la matière. Extrait le 27 mai 2018 de: grc.nasa.gov
- Alison H. (15/09/2006). Lancement de ballon. Extrait le 28 mai 2018 de: flickr.com

Personne n'a encore commenté ce post.