
Raison d'être et techniques de coloration de Kinyoun

La Tache de Kinyoun est une technique de coloration utilisée pour colorer les bactéries et les parasites acido-résistants. Il est né de la modification de la coloration Ziehl-Neelsen; Les deux techniques sont interprétées de la même manière mais diffèrent sur deux éléments: dans la préparation du réactif principal et en ce que la technique Kinyoun n'utilise pas de chaleur.
Pour cette raison, il est également connu sous le nom de tache à froid Ziehl-Neelsen ou Kinyoun modifiée à froid. Il est indiqué pour la coloration de Mycobacterium tuberculosis, Mycobacterium leprae, mycobactéries atypiques, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris Oui Cyclosporas cayetanensis.
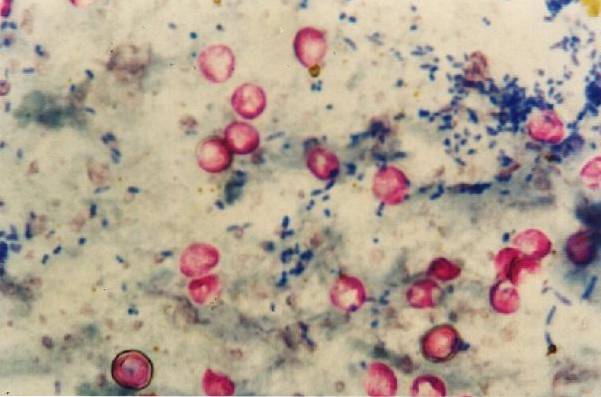
Il est à noter que les Nocardia se tachent faiblement avec cette technique car ils sont partiellement résistants aux acides et aux alcools, donc pour ce genre il y a une modification de la méthodologie.
À son tour, la technique de Kinyoun à froid a été combinée à la technique du trichrome modifiée par Didier pour la détection des coccidies (Cryptosporidium parvum et Isospora belli) et les spores de microsporidies (Enterocytozoon bieneusi Oui Encephalitozoon intestinalis).
Index des articles
- 1 Justification
- 2 Technique
- 2.1 Matériaux
- 2.2 Préparation de la carbol fuchsine de Kinyoun
- 2.3 Préparation de l'acide-alcool
- 2.4 Préparation du colorant de contraste bleu de méthylène
- 2.5 Technique de coloration Kinyoun
- 2.6 Technique spéciale kinyoun pour les nocardias
- 2.7 Technique combinée de carbol fuchsine et trichrome modifiée par Didier
- 2.8 Contrôle de la qualité
- 3 Technique Kinyoun par rapport à la technique Ziehl-Neelsen
- 4 Référence
Base
Le principal réactif de coloration est la carbolfuchsine ou carbol fuchsine, qui a la propriété de se lier aux acides carboliques existant au sein de la paroi cellulaire cireuse, riches en lipides (acides mycoliques) des mycobactéries et de certains parasites..
Cette liaison n'est pas contrecarrée par l'agent de blanchiment acide; par conséquent, les micro-organismes sont définis comme résistants aux acides et aux alcools.
Contrairement à la technique Ziehl-Neelsen -qui fixe le colorant à la chaleur-, dans la technique Kinyoun cette étape n'est pas nécessaire, car la solution de carbol fuchsine préparée pour cette technique contient une concentration élevée de phénol..
Le phénol dissout la matière lipidique dans la paroi cellulaire, permettant au colorant carbolfuchsine d'entrer. Une fois que le colorant a pénétré, il reste fixe malgré le lavage à l'alcool acide.
De cette manière, les micro-organismes résistants aux acides prennent la couleur rouge caractéristique, tandis que tout ce qui n'est pas de l'alcool résistant aux acides se décolore et se colore en bleu..
Technique
Matériaux
- Fuchsine carbol modifiée.
- Alcool-acide.
- Bleu de méthylène.
Préparation de Kinyoun Carbol Fuchsin
- Fuchsine de base: 4 gr.
- Phénol: 8 ml.
- Alcool (95%): 20 ml.
- Eau distillée: 100 ml.
La fuchsine basique doit être dissoute lentement dans l'alcool, en se mélangeant constamment. Ensuite, le phénol cristallisé est fondu dans un bain-marie à 56 ° C. Une fois dissous, 8 ml sont ajoutés à la solution de fuchsine préparée ci-dessus.
Préparation de l'acide-alcool
- Acide chlorhydrique concentré: 3 ml.
- Éthanol (95%): 97 ml.
Il doit être mesuré, joint et mélangé.
Préparation du colorant de contraste bleu de méthylène
- Bleu de méthylène: 0,3 g.
- Eau distillée: 100 ml.
Il est pesé et dissous.
Technique de coloration Kinyoun
1- Préparer un frottis directement à partir de l'échantillon, qui peut être des expectorations, du liquide pulmonaire, des sédiments urinaires, du liquide céphalo-rachidien ou des matières fécales, entre autres; ou à partir d'une suspension de microorganismes obtenue à partir de colonies pures développées dans des milieux de culture primaires.
2- Fixez le frottis avec de la chaleur.
3- Placer le frottis sur le pont de coloration et couvrir avec le réactif Kinyoun carbol fuchsine préparé. Laisser reposer 3 à 5 minutes.
4- Laver à l'eau distillée.
5- Blanchir avec de l'alcool acide pendant 3 minutes et laver à nouveau avec de l'eau distillée.
6- Blanchir à nouveau avec de l'alcool acide pendant 1 ou 2 minutes jusqu'à ce que plus aucune coloration ne soit emportée.
7- Laver à l'eau distillée et laisser égoutter en plaçant la lame en position verticale.
8- Couvrir la préparation de bleu de méthylène et laisser agir 4 minutes.
9- Laver à l'eau distillée et laisser sécher à l'air.
10- Examiner à 40X puis à 100X.
Si vous souhaitez améliorer et accélérer la coloration des microorganismes acido-résistants, ajoutez 1 goutte d'un agent mouillant (tel que Tergitol n ° 7) à 30 ou 40 ml de Kinyoun Carbol Fuchsin.
Certains laboratoires changent le colorant de contraste bleu de méthylène en acide vert vif ou picrique; le premier donne une couleur verte à l'arrière-plan et le second génère une couleur jaune.
Technique spéciale kinyoun pour les nocardias
Pour améliorer la coloration des bactéries du genre Nocardia, une modification du colorant Kinyoun est utilisée. La technique est la suivante:
1- Couvrir le frottis avec de la fuchsine Kinyoun carbol pendant 3 minutes.
2- Laver à l'eau distillée.
3- Décolorer brièvement avec de l'alcool acide préparé à 3% jusqu'à ce qu'il n'y ait plus de coloration.
4- Laver à nouveau avec de l'eau distillée.
5- Couvrir la préparation de bleu de méthylène et laisser reposer 30 secondes.
6- Laver à l'eau distillée et laisser sécher à l'air.
Technique combinée de carbol fuchsine et trichrome modifiée par Didier
Cette technique est recommandée pour l'analyse d'échantillons de selles pour les coccidies et les spores de Microsporidium sp en même temps. La procédure à suivre est la suivante:
1- Couvrir le frottis avec de la fuchsine Kinyoun carbol pendant 10 minutes.
2- Retirer le colorant et laver à l'eau distillée.
3- Blanchir pendant 30 secondes avec de l'alcool chlorhydrique.
4- Laver à nouveau avec de l'eau distillée.
5- Couvrir le frottis avec une solution de trichrome pendant 30 minutes à 37 ° C.
6- Laver à l'eau distillée.
7- Blanchir pendant 10 secondes avec de l'alcool acétique.
8- Laver le frottis pendant 30 secondes avec 95% d'éthanol.
Contrôle de qualité
En tant que contrôle positif, des frottis sont préparés avec des souches de Mycobacterium tuberculosis et colorer avec les réactifs préparés pour vérifier que les bactéries prennent la bonne couleur (rouge-fuchsia).
Des contrôles négatifs peuvent également être utilisés pour préparer des frottis avec n'importe quelle souche qui n'est pas acido-résistante, vérifiant ainsi que l'échantillon entier prend la couleur contrastante..
Technique Kinyoun par rapport à la technique Ziehl-Neelsen
La technique Kinyoun est plus simple puisqu'elle supprime l'étape de chauffage, mais son principal avantage est qu'elle évite l'émission de vapeurs, hautement toxiques et cancérigènes à long terme. Par conséquent, la tache de Kinyoun est plus sûre pour le personnel de coloration..
Il est important de prendre en compte le fait qu'il faut veiller à ce que les réactifs n'entrent pas en contact direct avec la peau, car ils sont corrosifs et l'eau de Javel est inflammable..
Quant aux inconvénients, un frottis négatif n'indique pas nécessairement que l'organisme n'est pas présent. De plus, la présence de débris cellulaires peut conduire à des faux positifs, conduisant à une confusion dans le diagnostic..
Référence
- Chimie clinique appliquée. (2016). Kit BK Kinyoun. Disponible sur: cromakit.es
- Orozco-Rico Miguel. Coloration de Kinyoun et deux coccidies dans le VIH. Journal médical MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Diagnostic microbiologique Bailey & Scott. 12 éd. Argentine. Éditorial Panamericana S.A.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. (5e éd.). Argentine, Éditorial Panamericana S.A.
- Contributeurs Wikipedia. «Tache de Kinyoun. Wikipedia, l'encyclopédie libre. Wikipedia, The Free Encyclopedia, 8 février 2018. Web. 5 janv.2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Mise en œuvre d'une technique de coloration pour le diagnostic simultané des coccidies et des microsporidies. Institut d'hygiène de l'Université de la République. Montevideo. Uruguay. Disponible sur: hygiene.edu.uy


Personne n'a encore commenté ce post.