
Mécanisme de transamination, fonction et exemples
La transamination est un type de réaction chimique qui fonctionne dans la "redistribution" des groupes aminés entre les acides aminés, car elle implique des processus d'amination réversibles (ajout d'un groupe amino) et de désamination (élimination d'un groupe amino), qui sont catalysés par des enzymes spécifiques connues comme transaminases ou aminotransférases.
La réaction de transamination générale implique l'échange entre un acide aminé et tout α-cétoacide, où l'échange d'un groupe amino donne la version cétoacide du premier acide aminé substrat et la version acide aminé du premier substrat α-cétoacide..

Le groupe amino qui est habituellement échangé est l'amino «alpha», c'est-à-dire celui qui participe à la formation des liaisons peptidiques et qui définit la structure des acides aminés, bien que des réactions impliquant d'autres groupes amino présents dans des positions différentes puissent également se produire..
À l'exception de la lysine, de la thréonine, de la proline et de l'hydroxyproline, tous les acides aminés participent aux réactions de transamination, bien que des transaminases aient été décrites pour l'histidine, la sérine, la méthionine et la phénylalanine, mais leurs voies métaboliques n'impliquent pas ce type de réactions..
Les réactions de transamination entre les acides aminés et les α-céto-acides ont été découvertes en 1937 par Braunstein et Kritzmann, et depuis lors, elles ont fait l'objet d'études intensives, puisqu'elles se produisent dans de nombreux tissus d'organismes différents et à des fins différentes..
Chez l'homme, par exemple, les transaminases sont largement distribuées dans les tissus corporels et sont particulièrement actives dans le tissu musculaire cardiaque, le foie, le tissu musculaire squelettique et les reins..
Index des articles
- 1 Mécanisme de réaction
- 2 Fonction de la transamination
- 3 exemples
- 4 Références
Mécanisme de réaction
Les réactions de transamination impliquent plus ou moins le même mécanisme. Comme discuté ci-dessus, ces réactions se produisent comme un échange réversible d'un groupe amino entre un acide aminé et un α-céto-acide (désaminé), produisant l'α-céto-acide de l'acide aminé donneur et l'acide aminé de l'α-céto-acide récepteur..
Ces réactions dépendent d'un composé connu sous le nom de pyridoxal phosphate, un dérivé de la vitamine B6 qui participe en tant que transporteur de groupes amino et qui se lie aux enzymes transaminases par la formation d'une base de Schiff entre le groupe aldéhyde de cette molécule et l'ε-amino d'un résidu de lysine dans le site actif de l'enzyme.
La liaison entre le phosphate de pyridoxal et le résidu de lysine dans le site actif n'est pas covalente, mais se produit par l'interaction électrostatique entre la charge positive d'azote sur la lysine et la charge négative sur le groupe phosphate du pyridoxal.
Au cours de la réaction, l'acide aminé qui fonctionne comme substrat déplace le groupe ε-amino du résidu lysine dans le site actif qui participe à la base de Schiff avec le pyridoxal.
Pendant ce temps, une paire d'électrons du carbone alpha de l'acide aminé sont éliminés et transférés au cycle pyridine qui compose le phosphate de pyridoxal (chargé positivement), puis «livrés» à l'acide α-céto qui fonctionne comme un deuxième substrat..
De cette manière, le phosphate de pyridoxal participe non seulement au transfert ou au transport de groupes aminés entre les acides aminés et les α-cétoacides qui sont des substrats des transaminases, mais agit également comme un «puits» d'électrons, facilitant la dissociation de l'acide alpha-aminé hydrogène.
En résumé, le premier substrat, un acide aminé, transfère son groupe amino au pyridoxal phosphate, d'où il est ensuite transféré vers le second substrat, un α-cétoacide, formant entre-temps un composé intermédiaire appelé phosphate de pyridoxamine..
Fonction de la transamination
Les enzymes transaminases se trouvent généralement dans le cytosol et les mitochondries et fonctionnent dans l'intégration de différentes voies métaboliques.
La glutamate déshydrogénase dans sa réaction inverse, par exemple, peut convertir le glutamate en ammonium, NADH (ou NADPH) et α-cétoglutarate, qui peut entrer dans le cycle de l'acide tricarboxylique et fonctionner dans la production d'énergie.
Cette enzyme, qui se trouve dans la matrice mitochondriale, représente un point de ramification qui associe les acides aminés au métabolisme énergétique, de sorte que lorsqu'une cellule manque suffisamment d'énergie sous forme de glucides ou de graisses pour fonctionner, elle peut alternativement utiliser certains acides aminés pour la même chose. objectif.
La formation de l'enzyme (glutamate déshydrogénase) au cours du développement cérébral est essentielle pour le contrôle de la détoxification de l'ammonium, car il a été démontré que certains cas de retard mental sont liés à une faible activité de celui-ci, qui conduit à une accumulation d'ammonium, qui est préjudiciable à la santé du cerveau.
Dans certaines cellules hépatiques, des réactions de transamination peuvent également être utilisées pour la synthèse du glucose par gluconéogenèse.
La glutamine est convertie en glutamate et en ammonium par l'enzyme glutaminase. Le glutamate est ensuite converti en α-cétoglutarate, qui entre dans le cycle de Krebs puis dans la gluconéogenèse. Cette dernière étape intervient grâce au fait que le malate, l'un des produits de la route, est transporté hors des mitochondries au moyen d'une navette..
Cette navette laisse l'α-cétoglutarate à la merci de l'enzyme malique qui le convertit en pyruvate. Deux molécules de pyruvate peuvent ensuite être converties en une molécule de glucose par gluconéogenèse..
Exemples
Les réactions de transamination les plus courantes sont liées aux acides aminés alanine, acide glutamique et acide aspartique..
Certaines enzymes aminotransférases peuvent, en plus du pyridoxal phosphate, utiliser le pyruvate comme «coenzyme», comme la glutamate-pyruvate transaminase, qui catalyse la réaction suivante:
glutamate + pyruvate ↔ alanine + α-cétoglutarate
Les cellules musculaires dépendent de cette réaction pour produire de l'alanine à partir du pyruvate et pour l'énergie à travers le cycle de Krebs via l'α-cétoglutarate. Dans ces cellules, l'utilisation de l'alanine comme source d'énergie dépend de l'élimination des groupes aminés tels que les ions ammonium dans le foie, à travers le cycle de l'urée..
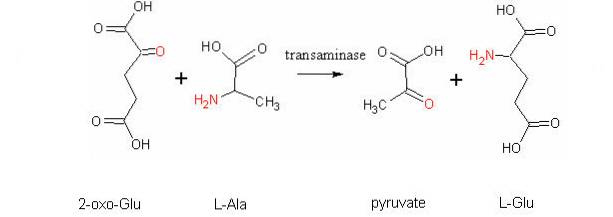
Une autre réaction de transamination très importante chez différentes espèces est celle catalysée par l'enzyme aspartate aminotransférase:
L-aspartate + α-cétoglutarate ↔ oxaloacétate + L-glutamate
Enfin, la réaction de transamination de l'acide γ-aminobutyrique (GABA), un acide aminé non protéique essentiel pour le système nerveux central qui fonctionne comme un neurotransmetteur inhibiteur. La réaction est catalysée par une transaminase d'acide γ-aminobutyrique et se déroule à peu près comme suit:
α-cétoglutarate + acide 4-aminobutanoïque ↔ glutamate + semialdéhyde succinique
Le semialdéhyde succinique est converti en acide succinique par une réaction d'oxydation et ce dernier peut entrer dans le cycle de Krebs pour la production d'énergie.
Les références
- Bhagavan, N. V. et Ha, C. E. (2002). Métabolisme des protéines et des acides aminés. Medical Biochemistry (4e éd.), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S., et Cohen, P. P. (1950). La portée de la réaction de transamination dans les tissus animaux. Journal of Biological Chemistry, 187, 439-452.
- Ha, C. E. et Bhagavan, N. V. (2011). Essentiels de la biochimie médicale: avec des cas cliniques. Presse académique.
- Litwack, G. (2017). Biochimie humaine. Presse académique.
- Rowsell, E. V. (1956). Transaminations avec du pyruvate et d'autres acides α-céto. Journal biochimique, 64 (2), 246.
- Snell, E. E. et Jenkins, W. T. (1959). Le mécanisme de la réaction de transamination. Journal de physiologie cellulaire et comparée, 54 (S1), 161-177.



Personne n'a encore commenté ce post.